Лікування спастичності з використанням ботулінічного нейротоксину типу А
Наукове положення Української асоціації боротьби з інсультом та Української асоціації фізичної терапії
Лікування спастичності з використанням ботулінічного нейротоксину типу А
Наукове положення Української асоціації боротьби з інсультом та Української асоціації фізичної терапії
О.С. Цуркаленко1, М.Я. Романишин2, О.Л. Кушнеренко3, І.Р. Гаврилів4, Ю.В. Фломін4, М.В. Гуляєва4, Л.В. Федоришин5, С.В. Фєдосєєв6, М.С. Бровченко7, В.Ф. Рассохін8, К.О. Карпінська9, Є.І. Цьома10, О.О. Левківський11, Л.Є. Осадча12
1 Дніпровський державний медичний університет, м. Дніпро;
2 КНП КОР «Київська обласна клінічна лікарня», м. Київ;
3 МЦ «Добробут» м. Київ;
4 МЦ «Універсальна клініка «Оберіг», м. Київ;
5 Львівський КНП ЛОР «Львівська обласна клінічна лікарня», м. Львів;
6 ДУ «Інститут неврології, психіатрії та наркології НАМНУ», м. Харків;
7 КНП «Київська міська клінічна лікарня №18», м. Київ;
8 Медичний центр «Ескулап», м. Київ;
9 КНП «Обласний клінічний центр нейрохірургії та неврології» ЗОР, м. Ужгород;
10 МЦ «Ужмед», м. Ужгород;
11 Реабілітаційний центр «Абіліс», м. Рівне;
12 ДУ Інститут травматології та ортопедії НАМН України
Резюме
Спастичність є проявом багатьох поширених неврологічних розладів, таких як мозковий інсульт, черепно-мозкова травма, розсіяний склероз, ушкодження спинного мозку, ішемічно-гіпоксична енцефалопатія, пухлини, спадкові та нейродегенеративні захворювання. Спастичність наявна у великої кількості пацієнтів, але, попри її негативний вплив на функціональний стан та якість життя, більшість пацієнтів не отримують належного лікування. У цьому науковому положенні ми узагальнили сучасні погляди на діагностику та лікування спастичності, приділяючи особливу увагу комплексному міждисциплінарному підходу та можливостям лікування з використанням ботулотоксину.
Вступ
Спастичність – це неврологічне порушення, яке може спричиняти скутість м’язів, біль, втрату об’єму рухів у суглобах, порушення рухових функцій та підвищення ризику падінь [50]. Поряд з цим, спастичність може призводити до виникнення низки вторинних ускладнень, таких як контрактури та деформація кін-цівок, пролежні, порушення сну, зниження настрою та самооцінки [133]. Спастичність є клінічним проявом багатьох неврологічних розладів, таких як мозковий інсульт, черепно-мозкова травма, розсіяний склероз, гіпоксично-ішемічна енцефалопатія, новоутворення та нейродегенеративні захворювання. Зважаючи на поширеність та негативний вплив на повсякденне життя пацієнтів, потреба у лікуванні спастичності є очевидною. Проте, судячи з великої кількості пацієнтів, які не отримують належного лікування, спастичності приділяється недостатньо уваги у широкій клінічній практиці. Розробка ефективних та безпечних методів лікування спастичності з використанням ботулотоксину робить розгляд цих питань актуальним та важливим [3, 36]. Крім того, спастичність – один з основних чинників, що знижують ефективність реабілітації пацієнтів з тяжкими захворюваннями [82, 125]. Спастичність перешкоджає формуванню нормальних рухових патернів під час від-новлення, а належне лікування спастичності може призвести до поліпшення рухових функцій як у гострому, так і у хронічному періоді захворювання [69].
Зважаючи на те, що спастичність є не ізольованим феноменом, а одним з проявів ураження верхнього мотонейрону, а патогенез її досі вивчений недостатньо, дати точне визначення спастичності виявилось непростим завданням. Перше визначення спастичності належить австралійському неврологу James W. Lance: «спастичність – це залежний від швидкості руху внутрішній опір пасивним рухам кінцівки у осіб з синдромом ураження верхнього мотонейрону» [64]. Однак, у визначенні Lance не враховується роль сенсорних порушень у виникненні спастичності. Тому, у 2005 році Програма з підтримки створення бази даних для оцінювання спастичності (Support Program for Assembly of a Database for Spasticity Measurement – SPASM) запропонувала оновлене визначення спас-тичності як «розладу сенсо-моторного контролю, що виникає внаслідок ураження верхнього мотонейрону та проявляється періодичною чи стійкою мимовіль-ною активацією м’язів» [17]. У цьому визначенні вра-ховані як вплив в’язко-еластичних властивостей м’яких тканин на скутість кінцівок, що передусім має значення у осіб похилого віку, так і роль пропріоцеп-ції та нервових шляхів шкіри [50].
Нещодавно спеціально створена Міждисциплі-нарна робоча група з рухових розладів (Interdiscipli-nary Working Group for Movement Disorders) визначила спастичність в більш широкому розумінні як «мимо-вільну гіперактивність м’язів за наявності центрального парезу» [36]. У цьому визначенні «мимовільна гіперактивність м’язів» описується як спектр проявів, що складається з наступних порушень:
- спастичність у вузькому розумінні, яка провокується швидкими пасивними рухами у суглобах,
- ригідність, яка провокується повільними пасив-ними рухами у суглобах,
- дистонія, коли мимовільна гіперактивність м’язів виникає спонтанно,
- спазми – складні мимовільні рухи, які зазвичай спричинені сенсорними або звуковими подразниками.
Міждисциплінарна Робоча група також запропонувала підхід до діагностики спастичності на основі чотирьох осей: клінічна картина (вісь 1), етіологія (вісь 2), локалізація (вісь 3) та додаткові порушення з боку центральної нервової системи (вісь 4) [36]. Крім того, спастичність можна умовно поділити на «фазову» та «тонічну» на підставі переважної участі або фазової (динамічної), або тонічної (статичної) складових м’язових рефлексів на розтягнення [48].
Точних епідеміологічних відомостей щодо спа-стичності поки недостатньо. Вважається, що спа-стичність вражає не менше, ніж третину пацієнтів після інсульту [50]. Деякі дослідники дійшли висновку, що певний ступінь спастичності виникає у 38–40% пацієнтів з інсультом, і 16% з них потребуватимуть лікування [62, 131]. Нещодавно Zeng et al. повідомили, що частота спастичності залежить від часу, коли відбувається оцінювання, і варіює від 27% через місяць після інсульту до 42,6% у віддаленому періоді (> 3 місяці від початку захворювання) [130, 136]. Інші автори також відзначали, що поширеність спастичності збільшується з часом: від 19% через 3 місяці після мозкового інсульту до 21,7% та 42,6% через 4 та 6 місяців відповідно [30, 72, 94]. Хоча у більшості пацієнтів спастичність формується протягом перших трьох місяців від початку захворювання, у окремих випадках вона може розвинутися пізніше. Тому важливо оцінювати спастичність як у підгострому, так і у віддаленому періоді захворювання [83]. Результати досліджень свідчать, що спастичність спостерігається у 34% – 84% пацієнтів після ЧМТ середнього та тяжкого ступеня [126].
Поширеність спастичності у осіб з ураженням спинного мозку коливається від 40% до 78% [101] Holtz et al. (2016) повідомляють, що частота спастичності після спінальної травми сягає 65%, причому близько 35% пацієнтів мають спастичність, яка важ-ко піддається лікуванню [58].
Церебральний параліч діагностується приблизно у 1,5–4,0 на 1000 новонароджених та є найпоширенішою причиною інвалідності серед дітей [13]. При цьому, спастичність є провідною складовою рухових порушень майже у 80% пацієнтів [38].
Приблизно 67% пацієнтів з розсіяним склерозом мають ті чи інші прояви спастичності, з них 38% мають помірну або тяжку спастичність, яка викликає обмеження повсякденної життєдіяльності [76].
Наявність спастичності спричиняє багато негативних наслідків, які призводять до значних порушень функціональної сфери та якості життя пацієнтів. Спастичність є значним економічним тягарем для будь-якої країни, бо значно обмежує працездатність дорослого населення, багато з уражених потребують стороннього догляду. Метою Наукового положення є розгляд сучасних підходів до діагностики та лікування спастичності, які дозволяють зменшити негативний вплив цього порушення на життєдіяльність пацієнтів. У цьому положенні особлива увага приділяється міждисциплінарним підходам до лікування, зокрема використанню ботулінічного нейротоксину типу А (БНТ-А), який дає можливість успішно проводити лікування фокальної/мультифокальної спастичності у різних категорій пацієнтів.
2. Спастичність: механізми формування та вплив на життя пацієнтів
2.1. Патофізіологія спастичності
Патофізіологія розладів м’язового тонусу в даний час
продовжує інтенсивно вивчатися у зв’язку з впливом різних структур головного і спинного мозку на стан та функції сенсомоторного апарату [61]. Ключовою ланкою патогенезу спастичності є порушення цент-ральної регуляції м’язового тонусу, яка забезпечується складним комплексом пригнічуючих та активуючих впливів різних відділів головного мозку. Спастичність виникає внаслідок порушення взаємодії різних спінальних і супраспінальних нейротран-сміттерних систем із наступними компенсаторними змінами всіх структур, які регулюють мимовільні та довільні рухові акти. Спінальний вплив на спастичність може бути наслідком як підвищення збуджуючої активності, так і від зменшення гальмівної. Виділяють наступні основні патофізіологічні причини спастичності: гіперзбудливість спінальних інтернейронів, підвищення збудливості рецепторів, формування нових синапсів внаслідок аксонального спраутінга, активація взаємодії гамма-мотонейронів з інтрафузальними м’язовими волокнами, підвищена збудливість альфа-мотонейронів [29, 40, 41]. Тварин-ні моделі продемонстрували роль мембранних властивостей мотонейронів у формуванні спастичності. Залежний від напруги постійний іонний ток, опосередкований натрій- та кальцій-залежними каналами, може спричинити тривалу деполяризацію, модульовану низхідною серотонінергічною та норадренергічною регуляцією [81]. У гострій стадії спінальної травми, через втрату низхідного моноамінергічного впливу, у вентральному розі виникає гіпоактивація рухових нейронів, а у дорсальному – дезінгібіція та збудження сенсорного входу [40]. Однак, не зважаю-чи на міжнейронну збудливість, спастичність розвивається не відразу, а тільки після відновлення збудливості рухових нейронів. У хронічній стадії в мотонейронах вентральних рогів виникає денерваційна гіперчутливість до моноамінергічного входу, що залишився; активується постійний іонний ток і розвивається спастичність. Окрім збудливих механізмів, що сприяють спастичності, роль змінених спінальних інгібіторних схем дедалі більше оцінюється в останніх дослідженнях [26, 81].
У фізіологічних умовах супраспінальний вплив обумовлює збалансованість тонусу м’язів за рахунок гальмівного впливу кортикоспінального, дорсального ретикулоспінального трактів та сприяючого впливу (на екстензорний тонус) медіального ретикулоспінального тракту [81]. Дорсальний ретикулоспінальний тракт також гальмує аферентні згинального рефлексу. У спинному мозку бічний канатик містить кортикоспінальний і дорсальний ретикулоспінальний тракти, тоді як передній канатик містить вестибулоспінальний та медіальний ретикулоспінальний тракти.
Ізольованого ушкодження кортикоспінального тракту недостатньо для виникнення спастичності [106]. Кіркові ураження призводять до формування спастичності опосередковано крізь кортикоретикулярні волокна, які пов’язують премоторну кору та медулярну ретикулярну формацію, звідки бере початок дорсальний ретикулоспінальний тракт. Геміплегія зі спастичністю виникає через непряму сприяючу дію медіального ретикулоспінального тракту, за відсутності гальмівного впливу дорсального ретикулоспінального тракту [48].
У випадку ураження спинного мозку можливо кілька варіантів:
- Неповна (часткова) мієлопатія, яка включає бічний канатик: якщо залучений тільки кортикоспінальний тракт, це призведе до слабкості, гіпотонії та втрати поверхневих рефлексів. Якщо додатково залучається дорсальний ретикулоспінальний тракт, розвинеться спастичність та гіперрефлексія через необмежену активність медіального ретикулоспінального тракту. Спастичність буде переважати в антигравітаційних м’язах. Якщо уражено ретикулоспінальний тракт, а кортикоспінальний є досі інтактним, то виникне спастичність без значної слабкості м’язів.
- Повна мієлопатія із залученням усіх чотирьох шляхів: у цьому випадку спастичність буде меншою через відсутність активуючої дії з боку медіального ретикулоспінального та медіального вестибулоспінального трактів. Пригнічення аферентного згинального рефлексу призведе до парезу та підвищення тонусу згиначів [48].
До нейрогенного компоненту, особливо з плином часу, приєднується біомеханічний компонент: зни-ження еластичності і вкорочення м’язів, зміни в сухожилках та інших тканинах, що значно погіршує клінічну картину. Якщо спастичність не буде адек-ватним чином скоригована, поступово виникає безперешкодне скорочення (спастична дистонія) в уражених групах м’язів, що призводить до аномальної установки кінцівки. Це, в свою чергу, перешкоджає подовженню м’язів і збільшує прояви спастичності [16]. Ранній початок лікування спастичності, навпа-ки, дозволяє поліпшити функціональні результати лікування [132].
2.2. Вплив спастичності на життя пацієнта та його родини.
Спастичність є вагомим чинником формування багатогранної функціональної неспроможності у пацієнтів з тяжкими неврологічними захворюваннями. Спастичність значно впливає на фізичний стан, об’єм та точність рухів, мобільність та самообслуговування, психоемоційний стан, сон, соціальні відно-сини, обумовлюючи у великій мірі рівень загальної якості життя пацієнтів [69, 133].
На початковому етапі відновлення легке або по-мірне підвищення м’язового тонусу, наприклад, у розгиначах нижніх кінцівок, може сприяти віднов-ленню функції ходи. Проте, у багатьох випадках подальше прогресуюче наростання тонусу призводить до розвитку м’язових контрактур і деформації суглобів [132]. На цьому етапі, окрім того, що пацієнти страждають від підвищеного м’язового тонусу, у них виникають опосередковані проблеми, які пов’язані з обмеженням рухової активності та зниженням здатності до самообслуговування (особистої гігієни, домашньої роботи, щоденної активності), що значно знижує якість їх життя [31].
Важливою проблемою постає і те, що більшість пацієнтів зі спастичністю страждають від болю [44]. Описано взаємозв’язок між розвитком спастичності та больовим синдромом: у 72% пацієнтів із вираженою спастичністю розвивався біль, у той час коли у пацієнтів без спастичності лише у 1,5% спостерігались больові відчуття [132]. Патофізіологічні основи больового синдрому при спастичності включають нейропатичний та ноцицептивний механізми. Ноцицептивний механізм обумовлений аномальним навантаженням на м’язи та сухожилки [67]. Спастичність призводить до зміни структурних властивостей м’язів, що з часом веде до фіброзу та атрофій. Часто пацієнти вказують на біль незалежно від наростання спастичності, що дає підставу думати про те, що біль є пов’язаним з тривалим аномальним скороченням м’язів [16].
2.3. Економічний вплив спастичності
Вплив спастичності на життя пацієнта є всеосяжним,
охоплюючи різні сфери: від повсякденних справ до психічного здоров’я і навіть доходу. Окрім значного погіршення якості життя пацієнтів, формування спастичності спричиняє значні економічні витрати внаслідок втрати працездатності, необхідності стороннього догляду та довготривалого лікування. У дослідженні Ganapathy et al. (2015) було встановлено, що працевлаштовані доглядальники за пацієнтом із післяінсультною спастичністю мали більше загальних обмежень у роботі (32%), прогулів (9%) та відгу-лів (27%). Середні загальні витрати внаслідок втрати продуктивності на працевлаштованого доглядальника становили 835 доларів США на місяць (>10000 доларів США на рік) [47].
Під час дослідження пацієнтів із розсіяним склерозом, у яких була визначена спастичність, був підтверджений її значний економічний вплив на ресурси охорони здоров’я та пов’язані з цим витрати. При цьому вартість медичної допомоги істотно зростала зі збільшенням ступеню спастичності. Раннє та ефективне лікування спастичності, навпаки, призводило до значної економії та до поліпшення якості життя, пов’язаної зі здоров’ям [112]. Спастичність, що викликана церебральним паралічем, асоціюється зі ще більшими економічними втратами [24].
Отже, значна спастичність корелює з вищими витратами на медичну допомогу, більшим навантаженням на систему охорони здоров’я та тягарем захворювань як для окремих пацієнтів та їх родин, так і для громад і країни в цілому [47].
3. Організація допомоги пацієнту із спастичністю
3.1. Загальні принципи та цілі.
Мультидисциплінарний підхід у лікуванні спастичності
Щоб запобігти інвалідизації, поліпшити функціональний стан пацієнтів зі спастичністю та зменшити соціально-економічний тягар, що пов’язаний з цим порушенням, необхідно налагодити систему поетапного ретельного спостереження за пацієнтами з неврологічними захворюваннями, які можуть супроводжуватись спастичністю. Постановка клінічного діагнозу базується на точній оцінці м’язового тонусу, ступеню спастичності та функціональних порушень на різних стадіях захворювання. Це дозволяє вчасно виявити виникнення патологічного м’язового гіпертонусу, розробити індивідуальний план лікувальних заходів, включаючи програму реабілітації та введення ботулінічного нейротоксину А (БНТ-А), із скеруванням пацієнта до спеціаліста, що має досвід ботулінотерапії [28].
Для правильної своєчасної діагностики та адекватного лікування м’язової спастичності, необхідна широка поінформованість неврологів і лікарів загальної практики щодо цієї патології.
Основною зацікавленою стороною впродовж реабілітаційного шляху є пацієнт, а також особи, які його доглядають. Залученість конкретних медичних працівників буде залежати від основної причини ураження верхнього мотонейрону та від стану пацієнта. Важливу роль у лікуванні також беруть фахівці з фізичної та реабілітаційної медицини, фізичні терапевти та ерготерапевти.
Початкова ланка маршруту пацієнта залежить від індивідуальних строків виникнення спастичності.
Відповідно, це можуть бути відділення гострого інсульту, неврологічні або нейрохірургічні відділення; пізніше – стаціонари реабілітаційних центрів; ще пізніше – лікарі первинної ланки, які регулярно спостерігають пацієнтів на стадії відновлення. У разі виявлення підвищеного м’язового тонусу, необхідно оцінити його вплив на порушення функції і, у разі необхідності, скерувати пацієнта до експертів у сфері лікування спастичності та ботулінотерапії (вторинна ланка). Паралельно з лікувальною роботою досвідчені фахівці з експертних центрів проводять навчальні тренінги для лікарів, які хочуть поглибити свої знання в цій темі та опанувати техніку введення БНТ-А. На сьогодні ботулінотерапія, що є терапією першої лінії при певних видах спастичності, не фінансується державою, і пацієнти змушені сплачувати таке лікування самостійно. Тісна взаємодія регіональних центрів, Української асоціації боротьби з інсультом, Української асоціації фізичної терапії, Українського товариства з рухових розладів та Громадської організації «Асоціація нейрореабілітації» із залученням їх представників до проведення вебінарів та лекцій, створення інформаційних ресурсів у медіа та інтернеті, допоможе змінити на краще ситуацію щодо діагностики та лікування спастичності. Відомо, що повторні освітні заходи як для лікарів, так і для груп пацієнтів щодо симптомів, які можуть з’явитися, наслідків спастичності, переваг раннього виявлення спастичності та підвищення обізнаності про всі варіанти лікування, включаючи ботулінотерапію, дозволяють збільшити прихильність до лікування та покращити реабілітаційний процес.
Проблема лікування та ранньої реабілітації пацієнтів зі спастичністю вимагає застосування комплексного підходу з урахуванням інтегральних показників якості життя, що визначаються ступенем неврологічного дефіциту, ефективністю соціальної адаптації. Адекватне ведення пацієнтів, які мають м’язову спастичність, вимагає дотримання мультидисциплінарних підходів, певних правил та своєчасного звернення до відповідних фахівців в залежності від клі-нічного стану [128].
Ефективність надання допомоги пацієнтам зі спастичністю залежить від особливостей перебігу основного захворювання. Основним параметром успіху є досягнення незалежності після повторного навчання таким базовим навичкам, як хода, їжа переодягання і, з рештою, реінтеграція в суспільство. Отже, успішна реабілітація залежить від всеосяжної, але динамічної програми, з відповідними цілями, які встановлюються та оцінюються у визначені періоди часу. Це може охоплювати стаціонарну допомогу, лікування у денному реабілітаційному відділенні лікарні чи амбулаторії, або реабілітацію на паліативному етапі. Потрібні цілеспрямовані індивідуальні втручання, які розроблені відповідно до того, чи спричинений спастичний парез інсультом, травмою, розсіяним склерозом чи церебральним паралічем. Навчання лікарів та пацієнтів щодо відповідної постановки цілей, а також наявних терапевтичних втручань, включаючи пероральні антиспастичні засоби, застосування БНТ-А та немедикаментозне лікування, є ключовою ланкою у поліпшенні результатів лікування [7].
3.2. Фізична терапія при спастичності
В цьому та інших розділах документу використовуються терміни, які не мають загальновизнаного трактування, але потребують чіткого пояснення.
На консенсусному засіданні Робочої групи Національних інститутів охорони здоров’я США у галузі педіатричних рухових розладів було визначено термін «селективний вольовий моторний контроль (СВМК)» як «можливість виконувати ізольовані рухи у суглобах за запитом, без використання згинальних/розгинальних патернів/схем та без небажаних рухів в інших суглобах» [18].
Порушення СВМК (при ураженні головного мозку) проявляється появою синергії, яка може бути згинальною, розгинальною або змішаною.
Загальноприйняте визначення м’язової синергії – стійка просторово-часова схема активації м’язів, одночасно задіяних у виконанні руху [79]: при намаганні зробити рух в одному суглобі він виникає відразу в двох та більше суглобах. Наприклад, при спробі пацієнта зігнути пальці кисті відбувається також згинання в зап’ястку, лікті та рух у плечовому суглобі. Другою ознакою синергії є зменшення активної амплітуди рухів при явно більшій пасивній амплітуді в суглобі [120].
На противагу синергії, щоб описати кращий рівень СВМК, часто вживають термін селективний рух, який має на увазі, що пацієнт може виконати рух в будь-якому суглобі, з будь-якою швидкістю, в будь-якому напрямку без небажаних рухів в інших суглобах [103].
Спастичність є одним із компонентів синдрому ураження верхнього мотонейрону. Отже, розглядати її окремо як стратегію управління/менеджменту у фізичній терапії недоцільно. Одним із завдань фізичного терапевта є виявлення рухового порушення, яке впливає на діяльність та участь пацієнта. Фізичний терапевт (ФТ) повинен зосередити свою увагу на цілях пацієнта, а не лише на зменшенні рівня спастичності м’язів [117]. Інакше кажучи, обрані ФТ види та методи втручання мають впливати на збільшення рівня участі та діяльності пацієнта, а не на зниження рівня спастичності м’язів.
Обрані фізичним терапевтом втручання повинні бути збалансовані між руховою терапією та позиціонуванням. У провідних наукових роботах не запропоновано узгодженої доказової моделі менеджменту спастичності. Більшість розробленого матеріалу ґрунтується на логічному та прагматичному підході, ключовими компонентами якого є навчання усіх залучених до покращення рухової функції, включаючи самого пацієнта, його сім’ю, опікунів/доглядальників та працівників сфери охорони здоров’я.
Ключові компоненти менеджменту спастичності включають: безпеку та участь команди; орієнтованість на пацієнта; чіткі цілі; залучення до процесу пацієнтів та їх родин.
Визначення впливу рівня спастичності на діяльність пацієнта
Спастичність є лише одним із кількох рухових порушень після ушкодження роботи мозку. ФТ необхідно оцінити, як спастичність впливає на рухову функцію пацієнта. Кілька років тому більшість фахівців розглядали спастичність як основний чинник, що обмежує рухову активність людини. Однак Landau поставив це припущення під сумнів [65]. З того часу все більше проведених досліджень підтверджують його позицію. Визначено, що зниження рівня спасичності у певних м’язах у пацієнтів після інсульту [78] та у дітей з церебральним паралічем [84, 86] не призводить до покращення СВМК. Інші проведені дослідження, що вивчали зв’язок між спастичністю та злагодженою роботою м’язів, також не виявили кореляції [91, 100]. Ці дослідження дозволяють стверджувати, що порушення селективного вольового моторного контролю (СВМК) – це окреме рухове порушення, яке не залежить від рівня прояву спастичності.
Спастичність та рухові порушення
Спастичність часто сприймають як ключову причину низького рівня рухової функції руки. Внаслідок неврологічних уражень у пацієнтів спостерігаються порушення функціонування м’язів з морфологічними змінами в них та з’являються контрактури [70], які призводять до вимушеного положення руки. Такі вимушені нефункціональні положення пов’язані з низьким рівнем СВМК, а не з рівнем прояву спастичності. Саме порушений СВМК, а не спастичність, є основною причиною інвалідності [109]. Наприклад, у одному з рандомізованих досліджень ін’єкція БНТ-А в м’язи руки зменшила надмірну спастичність (згинання кисті) та пов’язаний з цим біль [14]. Разом з тим, проявилася слабкість цих м’язів, що зрештою призвело не до очікуваного покращення рухової функції, а до її зниження [14]. Таким чином, зниження рівня спастичності після ін’єкції БНТ-А буде призводити до прояву слабкості м’язів та не завжди до підвищення рівня функціонування пацієнтів. ФТ при виборі методів втручання повинен вміти визначати окремо рівень порушення СВМК та рівень спастичність. Це дозволить йому визначати реаліс-тичні цілі втручання.
Втручання
На сьогоднішній день відсутні докази щодо ефективного втручання з тривалим ефектом, яке доступне фізичному терапевту і спрямоване виключно на зменшення рівня спастичності. Існує невелика кількість рандомізованих контрольованих досліджень або систематичних оглядів, які демонструють короткочасний ефект від проведеного втручання. Наприклад, Graci-es [49] застосовував динамічні шини, виготовлені з лайкри, для руки протягом трьох годин для пацієнтів після інсульту. У результаті дослідження спостерігалося короткотривале зменшення рівня спастичності. Ageranioti [2] використовував вібрацію для впливу на м’яз-антагоніст у пацієнтів після інсульту, у результаті чого спостерігалось незначне та короткотривале зменшення рівня спастичності м’язу-агоніста. Дотепер немає доказів, які б підтверджували, що зниження рівня спастичності у пацієнтів з церебральним паралічем покращить їхній рівень СВМК [66, 89].
ФТ повинен усвідомлювати, що після введення БНТ-А у цільові м’язи у пацієнта зменшиться лише рівень спастичності: рівень СВМК залишиться без змін. Фізичному терапевту необхідно визначити вплив спастичності на обмеження активності пацієнта. Втручання повинно включати навчання пацієнта контролювати м’язи для виконання визначених функціональних завдань, одночасно уникаючи над-мірної м’язової активності. У пацієнтів, які не можуть виконувати функціональні завдання, необхідно підтримувати здатність до розтягу м’яких тканин. Використання ортезів під час заняття забезпечує від-повідну біомеханічну корекцію.
Пасивний розтяг спастичних м’язів
Донедавна, найпоширенішим втручанням у фізичній терапії при спастичності був розтяг спастичних м’язів. Це втручання потребує витрат значних ресурсів як з боку пацієнта, так і фізичного терапевта. При цьому результат від застосування – вкрай сумнівний [55]. На сьогоднішній день вже є клінічні настанови, які не рекомендують використання розтягу у фізичній терапії при спастичності у пацієнтів після інсульту [25].
Дотепер серед експертів немає єдиної думки, чи вважати збільшення пасивної амплітуди рухів в суглобах на 5 або 10 градусів (після виконання пасивного розтягу спастичних м’язів) клінічно значущим [63]. Жодне дослідження не вивчало ефект від розтягу спастичних м’язів через 7 місяців після завершення втручання. Тому, фізичному терапевту не рекомендовано застосовувати пасивний розтяг спастичних м’язів як основне втручання при спастичності. Якщо пацієнти мають довільний рух, то ФТ повинен максимально залучати пацієнта до виконання активних рухових завдань.
Усунення надмірної м’язової активності
У минулому фізичні терапевти не рекомендували пацієнтам навантажувати будь-які спастичні м’язи через побоювання, що це підвищить рівень спастичності [10]. Однак, отримані результати досліджень свідчать, що після програми силового тренування рівень спастичності не збільшився порівняно з контрольною групою [92, 115]. Водночас, спастичні м’язи є слабкими, що було виявлено у пацієнтів з церебральним паралічем [127]. Дослідження впливу силового тренування на пацієнта з церебральним паралічем продемонструвало поліпшення його функціонування, не фіксуючи при цьому збільшення рівня спастичності м’язів [27, 71]. Силові тренування у пацієнтів з церебральним паралічем виявилися такими ж ефективними для збільшення рівня функціонування, як і селективна дорсальна ризотомія в комплексі з силовими тренуваннями [77]. Необхідно тренувати силу м’язів, які є ключовими для виконання повсякденної активності пацієнта (наприклад, литкові м’язи, які найчастіше піддаються впливу спастичності). Включення вправ з ексцентричним скороченням м’язів під час занять може бути особливо корисним, оскільки воно передбачає навчання паці-єнта контролю м’язової активності. Наприклад, литкові м’язи працюють ексцентрично під час фази опори ходи, здійснюючи контроль руху гомілки вперед над стопою, а потім ізометрично – при блокуванні стопи і підйомі п’яти. Збільшення кількості повторень в межах заняття може бути досягнуто за допомогою ортезування гомілковостопного суглобу [5, 80].
Тренування відповідних м’язів
Надмірне напруження м’язів може бути проявом як спастичності, так і відсутності рухового навику. У будь-якому випадку, під час заняття фізичному терапевту доведеться модифікувати умови виконання рухового завдання, щоб пацієнт зміг взяти участь у ньому без надмірної м’язової активності. Наприклад, під час відпрацювання вставання зі стільця навантаження на розгиначі коліна буде зростати зі зменшенням висоти стільця [Burdett, 1985]. Якщо вставання зі стільця стандартної висоти є занадто складним для пацієнта, спроба встати може призвести до надмірної м’язової активності, і це часто це сприймають як спастичність. Якщо завдання модифіковано так, що пацієнт відпрацьовує вставання з вищого стільця, то навантаження на розгиначі коліна зменшується, чим забезпечується оптимальне відпрацювання завдання. Пацієнт зможе утримувати більшу вагу на слабкій нозі, уникаючи адаптивних реакцій, що спостерігаються при вставанні зі стільця меншої висоти [19].
У дітей та дорослих з глибоким геміпарезом чи геміплегією може спостерігатись тенденція до невикористання слабкої верхньої кінцівки. Доведено, що рухова терапія індукована обмеженням є ефективною для подолання цієї проблеми як у дорослих [53], так і у дітей [20, 21, 42, 57, 114]. Основною умовою для застосування цього втручання є такий рівень СВМК, який забезпечить здатність утримувати предмети та розгинати пальці, тобто відповідає групам відмінного та доброго відновлення за алгоритмом PREP2 (Predict REcovery Potential – інструмент визначення можливості відновлення).
Профілактика змін у м’яких тканинах
Профілактика виникнення контрактури важлива тому, що існує зв’язок між рівнем спастичності та роз-витком контрактури [1]. Довжину спастичних м’язів слід підтримувати за допомогою активних тренувань. Якщо пацієнт не може активно виконувати рухове завдання, то застосовують пасивні методи. Слід тренувати м’язи по всій наявній амплітуді руху для того, щоб відпрацьовувати довільне скорочення м’яза та його антагоніста. ФТ обирає стратегію рухового тренування для верхньої кінцівки залежно від наявного рівня СВМК пацієнта.
4. Оцінка стану пацієнта зі спастичністю та постановка цілей.
Точна оцінка стану пацієнта та встановлення діагнозу є відправною точкою для складання належного клінічного маршруту та планування лікування. Оцінка складається з двох частин: опитування пацієнта та фізичного обстеження.
При зборі скарг та анамнезу важливо уточнити час початку захворювання та час виникнення спастичності (як правило, вони відрізняються), хронологію неврологічного ураження (спастичність змінюється з часом), наявність супутніх станів, що можуть провокувати чи підсилювати спастичність, таких як: будь-який дискомфорт (холод, закрепи, порушення сечопуску, пролежні), біль, інфекції, надмірне зусилля пацієнта (сидіння чи стояння без достатньої підтримки), емоційне навантаження. Необхідно оцінити вплив спастичності на спричинені нею обмеження функції. Крім того, важливо враховувати, що спастичність може в деяких випадках полегшувати виконання певних побутових дій (наприклад, утримувати предмети).
Потрібно встановити асоційовані симптоми та клінічні наслідки спастичності:
- Клонуси, спазми;
- Біль;
- Контрактури;
- Якість сну та мобільність у ліжку;
- Стан шкіри: наявність ушкоджень або пролежнів;
- Мобільність у просторі: використання допоміжних засобів, швидкість та відстань пересування, падіння.
Необхідно з’ясувати, які методи або ліки раніше застосовувалися для лікування спастичності, та ступінь їх ефективності. Важливою є інформація про освіту пацієнта, його професійні навички, досвід роботи, переваги в організації дозвілля, побутові звички.
При об’єктивному обстеженні необхідна оцінка ступеня виразності рухового розладу: порушення м’язової сили, м’язового тонусу, СВМК, об’єму пасивних і активних рухів, поверхневої і глибокої чутливості. Окрему увагу слід приділяти виразності когнітивних і мовних порушень, синдромам апраксії та ігнорування.
Всі ці дані потрібні для визначення та узгодження цілей лікування з пацієнтом, його родиною/доглядальниками та визначення тактики лікування.
Обстеження пацієнта зі спастичністю фізичним терапевтом:
- Проведення тестування на визначення рівня СВМК (Selective Control Assessment of the Lower Extremity (SCALE), Selective Control of the Upper Extremity Scale (SCUES), Chedoke-McMaster Stro-ke Assessment, Fugl-Meyer Assessment);
- Проведення тестування на функціональну діяльність (вибір тестів буде залежати від рівня СВМК, запиту/побажання пацієнта та виду діяльності, який необхідно оцінити).
Для верхньої кінцівки:
– визначення групи відновлення рухової функції верхньої кінцівки за допомогою алгоритму PREP2. Ціль для верхньої кінцівки – визначення можливості зменшення спастичності окремих груп м’язів для покращення конкретних видів рухової діяльності або догляду за кінцівкою.
Для нижньої кінцівки:
– проведення спостережного аналізу ходи за Rancho. Ціль для нижньої кінцівки – визначення можливості зменшення спастичності у вибраних групах м’язів для покращення функції ходи або догляду за пацієнтом;
- Аналіз зібраних даних для прийняття рішення щодо можливості зниження спастичності в окремих м’язах, за умови, що це допоможе у виконанні конкретної рухової діяльності пацієнта або покращить догляд за пацієнтом.
- співставити порушення рухової функції з виявленими ураженнями органів і систем,
- співвіднести реалістичність запиту пацієнта і його рівня функціонування,
- визначити потенційні м’язи, у які можливо ввести БНТ-А для покращення рівня функціонування пацієнта або догляду за ним.
Верхня кінцівка
Для аналізу зібраних даних для верхньої кінцівки можна використовувати алгоритм PREP2 [116].
Алгоритм PREP2 поєднує клінічні та нейрофізіологічні обстеження для прогнозування результату відновлення рухової функції верхньої кінцівки через 3 місяці після інсульту, розподіляючи пацієнтів на 4 групи:
- Відмінне відновлення. Немає значного ураження СВМК, і всі види активності повсякденного життя пацієнт виконує рукою у спосіб, як він це робив до інсульту.
- Добре відновлення.У пацієнта є ураження СВМК, але він здатний виконувати певну частину активності повсякденного життя рукою, хоча і у інший спосіб, ніж до інсульту.
- Обмежене відновлення. У пацієнта є ураження СВМК, і він не здатний виконувати активності повсякденного життя рукою. Попри наявний незначний рух у кінцівці, його не-достатньо для функціонального залучення руки.
- Погане відновлення. У пацієнта є ураження СВМК, рухи у кінцівці повністю відсутні, що призводить до нездатності виконувати активності повсякденного життя рукою.
Рамка 1. Модифікована шкала Ешворта
Акронім: mAS
Опис: Оцінка від 0 до 4 [11].
Розшифрування оцінок модифікованої шкали Ешворта [4]:
«0» немає підвищення м’язового тонусу.
«1» незначне підвищення м’язового тонусу, що проявляється швидким скороченням м’язу «хапанням м’язу» з наступним його розслабленням чи мінімальним опором в кінці амплітуди руху при згинанні чи розгинанні ураженої кінцівки.
«1+» незначне підвищення м’язового тонусу, що проявляється швидким скороченням м’язу «хапанням м’язу» з наступним його мінімальним опором до руху протягом подальшої амплітуди (але не більше ніж половина амплітуди) руху.
«2» більш виражене/помірне підвищення м’язового тонусу, що проявляється швидким скороченням м’язу «хапанням м’язу» з наступним його мінімальним опором до руху протягом більше половини амплітуди руху, проте уражена кін-цівка рухається легко.
«3» значне підвищення м’язового тонусу, пасивний рух здійснюється важко.
«4» уражена кінцівка має ригідність під час згинання та розгинання.
Час виконання <5 хвилин залежно від кількості обстежуваних м’язів/суглобів.
Ці групи PREP2 слід використовувати при узгодженні відповідності запиту пацієнта щодо можливості відновлення функції верхньої кінцівки [116].
При зверненні пацієнта до ФТ він повинен визначити, в якій групі відновлення знаходиться пацієнт для реалістичної постановки цілі втручання [113]. На сьогодні є дослідження, які демонструють, що визначена група відновлення для пацієнта на третій місяць після інсульту збігається на 83% з його групою через два роки після інсульту [108]. Фізичну терапію необхідно модифікувати під наявний стан СВМК пацієнта, оскільки методів впливу на СВМК з вірогідно доведеною ефективністю не існує. На сьогодні ще є плутанина між спастичністю та СВМК, і ФТ повинен вміти їх диференціювати. Якщо для визначення рівня спастичності він використовує модифіковану шкалу Ешворта, то групи відновлення верхньої кінцівки за алгоритмом PREP2 допоможуть йому оцінити рівень СВМК, а відповідно і функціонального залучення руки до повсякденної активності.
Варто пам’ятати, що більшість пацієнтів несвідо-мо звертаються із запитом покращення саме СВМК. Усунення спастичності, яку часто діагностують та усувають за допомогою БНТ-А, не призводить до автоматичного покращення СВМК.
На основі запиту/побажань пацієнта виставляється ціль втручання. Для цього ФТ повинен співставити рівень спастичності, групу відновлення і запит пацієнта.
Якщо запитом пацієнта або опікуна є догляд (тобто ціль є пасивною), то ФТ повинен визначити, що саме перешкоджає здійсненню догляду. Якщо причиною є саме спастичність м’язів, слід розглянути разом з іншими членами мультидисциплінарної команди можливі шляхи її зниження [46].
Нижня кінцівка
Навіть при значному порушенні СВМК нижньої кін-цівки пацієнти зберігають здатність до ходи. Отже потреби у класифікації за групами відновлення нижньої кінцівки немає.
ФТ повинен орієнтуватись на запит/побажання пацієнта. Якщо запитом є покращення функції ходи, наприклад її швидкості чи безпеки, то ФТ повинен провести спостережний аналіз ходи [122]. Перед реалізацією втручання необхідно встановити причину порушення ходи. У світі є багато систем, що аналізують ходу [118]. Українська асоціація фізичної терапії рекомендує українським фізичним терапевтам використовувати одну з них – спостережний аналіз ходи за Rancho (Rancho Los Amigos Observational Gait Analysis system – Rancho OGA). Дана система [90] давно зарекомендувала себе як надійний та валідний інструмент виявлення причин відхилень у ході і не поступається апаратним методам оцінки порушень ходи [52]. Необхідно зауважити, що дана система дозволяє фізичному терапевту виявити не лише видиме порушення, але і визначити причину цього видимого порушення. Якщо однією з причин порушення ходи пацієнта є спастичність, то необхідно розглянути доцільність введення БНТ-А у цільові м’язи.
Якщо запитом пацієнта або опікуна є догляд (тобто ціль є пасивною), то ФТ повинен визначити, що саме перешкоджає здійсненню догляду. Якщо причиною є саме спастичність м’язів, слід розглянути разом з іншими членами мультидисциплінарної команди можливі шляхи її зниження.
Постановка цілей
Існує чіткий консенсус, що при визначенні цілей необхідно активно залучати осіб, які перенесли інсульт, та їх родини/опікунів [134].
Сьогодні виділяють дві великі групи можливих цілей при використанні БНТ-А: активні та пасивні [110]. Активна ціль передбачає, що пацієнт має запит опанувати певний вид діяльності, який у нинішньому стані він виконати не може. Пасивна ціль передбачає, що жодної активної участі з боку пацієнта для досягнення цілі не потрібно (як правило, це полягає у покращенні догляду за пацієнтом).
Активну ціль фізичному терапевту слід розглядати як опанування пацієнтом нової рухової навички (діяльності), виконанню якої перешкоджає саме спастичність, і її усунення зробить можливим або полегшить виконання бажаної діяльності.
Пасивна ціль зазвичай виставляється за навності труднощів у догляді чи позиціюванні пацієнта, і запит частіше надходить не від самого пацієнта, а від опікуна/доглядальника чи родини. У такому випадку ФТ має оцінити, чи зможе зниження спастичності покращити догляд чи позиціонування пацієнта.
Додатковими цілями можуть бути полегшення болю, зменшення проявів мимовільних рухів (наприклад, синкінезії, м’язові спазми) або профілактика контрактур і деформацій суглобів.
При постановці цілей доцільно користуватись простим і широко вживаним форматом постановки цілей SMART [12].
Критерії постановки цілей у SMART форматі:
- Specific/Конкретна. Ціль повинна бути точно визначеною. Необхідно визначити ціль недвозначно, без нечіткого та незрозумілого формулювання. Пацієнт та його родина дуже часто формулюють власне бачення результату терапії, використовуючи такі запити, як «покращення руки» або «відновлення ноги», чого фізичному терапевту необхідно уникати та чітко формулювати і визначати цілі. Необхідно з’ясувати:
– хто задіяний у процесі,
– чого необхідно досягти,
– де це буде зроблено,
– чому це необхідно зробити.
- Measurable/Вимірювана. Процес фізичної терапії повинен мати точно визначену кінцеву мету, яку можна оцінити та виміряти. Необхідно, щоб у процесі фізичної терапії була можливість стежити за прогресом та недвозначно оцінити результат втручання.
Використання спеціальних шкал значно полегшує цей процес, однак для пацієнта та його родини кращою оцінкою буде певна діяльність, яку він опанує. Наприклад, покращення на п’ять балів за індексом мобільності Рівермід може не продемонструвати ні пацієнту, ні його родині жодного прогресу, а опанування пересідання з ліжка на візок без сторонньої допомоги чітко продемонструє визначену та конкретно вимірювану ціль. Відповідно, такий підхід дозволить пацієнту та його родині знати, коли вона буде досягнута.
- Achievable/Досяжна. Щоб ФТ розумів, що поставлена ціль знаходиться у межах досяжного покращення рухової функції пацієнта, необхідний певний клінічний досвід. Для оцінювання реаліс-тичності запиту пацієнта щодо верхньої кінцівки ФТ може користуватись групами відновлення за алгоритмом PREP2.
- Relevant/Доречна. Необхідно визначити ціль втручання, що відповідає основній потребі пацієнта. Дуже часто пацієнт та його родина мають запит на хибні цілі, які не стосуються вирішення проблеми. Завдання ФТ полягає у тому, щоб з’ясувати, визначити та пояснити, чому досягнення даної цілі є першочерговим завданням. Також фізичному терапевту необхідно врахувати, чи поставлена ціль відповідає іншим потребам пацієнта, які було ви-явлено, і як вони співвідносяться щодо короткотривалих і довготривалих його планів.
- Timely/Визначена у часі. Кожна встановлена ціль повинна мати чіткі часові рамки її досягнення.
5. Лікування фокальної спастичності з використанням БНТ-А
5.1. Що таке БНТ-А, і як він працює
Ботулінічний токсин – це нейротоксин, що виробляється бактерією Clostridium botulinum, основний механізм дії якого полягає в блокуванні холінергічної передачі – вивільнення ацетилхоліну в нейром’язовому синапсі за рахунок блокади транспортного білка SNAP-25. Ефект від його внутрішньом’язового застосування проявляється локальним зниженням тонусу та сили м’язів, в які було введено БНТ-А, протягом декількох місяців після ін’єкції [61]. За даними рандомізованих плацебо-контрольованих, подвійних сліпих досліджень, ботулінотерапія визнана високоефективним і безпечним способом корекції постінсультної спастичності. З 2016 року Американська академія неврології оцінила застосування БНТ-А як лікування з найвищим рівнем доказовості (рівень А) при постінсультній спастичності [85, 107].
Першим в медичній практиці БНТ-А застосував американський офтальмолог Алан Скотт у 1977 році у пацієнта зі страбізмом. У 1978 році A. Scott очолив пілотне дослідження, результати якого були опубліковані у 1980 році [105]. За дуже короткий час після цієї публікації застосування БНТ в якості лікувального методу розповсюдилось на неврологію та інші сфери медичної діяльності – естетичну медицину, урологію, проктологію, гінекологію, медицину болі. БНТ-А є пептидною сумішшю, що складається з нейротоксину (біологічно активного компоненту) і нетоксичних протеїнів. Нейротоксин складається з двох поліпептидних ланцюгів (легкого, 448 амінокислот з масою 50 кілодальтон, і важкого, 832 амінокислоти з масою 100 кДальтон), з’єднаних однією дисульфідною групою і атомом цинку. Легкий ланцюг являє собою ендопептидазу з протеолітичною активністю, важкий ланцюг забезпечує холінергічну специфічність і просування легкого ланцюга через ендосомальну мембрану.
При такій структурі молекула нейротоксину дуже лабільна, нестійка до дії механічних, фізичних і хімічних чинників, що призводять до втрати біологічної активності. На сьогодні в Україні та країнах Європейського Союзу зареєстровані три препарати БНТ-А: онаботулотоксин (патентована торговельна назва Ботокс, надалі «ОНА») абоботулотоксин (патентована торговельна назва Диспорт, надалі «АБО»), інкоботулотоксин (патентована торговельна назва Ксеомін, надалі «ІНКО»). Два з них (АБО та ОНА) містять в своєму складі нейротоксин та комплексоутворюючі білки – молекули гемагглютініну і нетоксичних протеїнів. Комплексоутворюючі білки є чинником, який сприяє утворенню нейтралізуючих антитіл до всього нейротоксин-гемагглютінінового комплексу, що може стати причиною розвитку вторинної нечутливості (резистентності) при повторних ін’єкціях БНТ-А [45]. В ІНКО, за рахунок сучасної системи стабілізації та очистки (хроматографія), нетоксичний протеїн від-сутній, що значно зменшує ймовірність утворення нейтралізуючих антитіл [56]. При цьому ІНКО характеризується високим ступенем стабільності в умовах впливу зовнішнього середовища.
Механізм дії всіх препаратів БНТ-А полягає в пресинаптичній блокаді вивільнення ацетилхоліну з нервової терміналі периферичного холінергічного синапсу, його можна описати чотирикроковим послідовним процесом:
- зв’язування: важкий ланцюг ботулінічного нейротоксину типу А зв’язується з виключно високою селективністю і спорідненістю з рецепторами, які знаходяться тільки на холінергічних нервових закінченнях;
- інтерналізація: звуження мембрани нервового закінчення і всмоктування токсину через нервове закінчення (ендоцитоз);
- транслокація: амінокінцевий сегмент важкого ланцюга нейротоксину утворює пору у везикулярній мембрані, дисульфідний зв’язок розщеплюється, і легкий ланцюг нейротоксину проходить через цю пору в цитозоль;
- ефект: після вивільнення легкого ланцюга він дуже селективно розщеплює білок-мішень (SNAP 25), важливий для виділення ацетилхоліну.
Процес пресинаптичного розщеплення SNAP-25 ботулінічним нейротоксином-А є незворотнім і займає в середньому 30–60 хвилин. Проте, клінічна міорелаксуюча дія препаратів БНТ-А починає проявлятися пізніше, частіше за все через 2–7 днів. Максимальна дія препаратів БНТ-А як завжди відзначається на 2–3 тижні з моменту введення.
Повне відновлення функції кінцевої пластини/передачі імпульсів після внутрішньом’язової ін’єкції в нормі відбувається через 3–4 місяці, протягом яких нервові закінчення проростають (спраутінг) і відновлюють зв’язки з пластиною рухового нерва.
![Таблиця 1. Властивості різних препаратів БНТ-А [45, 60, 93, 99, 121]](https://uziortho.com.ua/wp-content/uploads/2023/04/Ashampoo_Snap_11-апреля-2023-г._15h03m55s_001_.jpg)
5.2. Препарати БНТ-А та їх основні характеристики
На сьогоднішній день в Україні та країнах Європейського Союзу схвалено три препарати БНТ-А, що використовуються у лікуванні спастичності (Таблиця 2).
5.3. Протипоказання до призначення ботулотоксину типу А
У кожного препарату БНТ-А є свій спектр показань до лікування, в той час як протипоказання для проведення ботулінотерапії є загальними: підвищена чутливість до діючої речовини або до будь-якої з допоміжних речовин препарату, генералізовані розлади м’язової активності (наприклад міастенія гравіс, синдром Ламберта-Ітона), інфекція або запалення у об-раній для ін’єкції ділянці.
5.4. Досвід застосування та безпека використання високих доз БНТ-А поза зареєстрованими показаннями (off-label)
Згідно офіційної інформації про лікарські препарати, доза БНТ-А не повинна перевищувати 400 МО для ОНА та ІНКО, і 1500 МО для АБО з метою уникнення важливих негативних наслідків та вироблення антитіл проти нейротоксину. Проте, у клінічній практиці для досягнення конкретних функціональних цілей часто виникає потреба у використанні більших загальних доз БНТ-А [9, 95, 129, 134].
За останні роки було проведено 13 досліджень (три з використанням ОНА, 8 з використанням ІНКО та 2 з використанням обох зазначених препаратів), спрямованих на вивчення ефективності та безпеки використання високих доз БНТ-А. Два з цих досліджень мали дизайн рандомізованого контрольованого клінічного випробування [6, 73].
В більшості досліджень використовувалось дозування від 400 до 800 МО БНТ-А [23, 102]. В одному дослідженні [59] вивчалась ефективність та безпека використання 1000 МО ІНКО для лікування спа-стичності відповідно до особливостей та потреб окремого пацієнта [59]. В усіх згаданих дослідженнях було продемонстровано поліпшення функції кінцівки, зменшення спастичності та болю, збільшення тривалості клінічного ефекту БНТ-А у порівнянні з використанням стандартних доз. Серйозних небажаних явищ не спостерігалося. Високі дози БНТ-А виявилися безпечними та ефективними у пацієнтів з післяінсультною спастичністю кінцівок [23, 102, 129]. Проте їх використання потребує подальших досліджень.
Отже, у окремих випадках можливо використовувати високі дози (до 840 МО) ІНКО. Це може мати сенс, наприклад, при виразній спастичності верхньої і нижньої кінцівки. Правильний підбір дози ІНКО дозволяє збільшити реабілітаційний потенціал хворих [33]. Безпека використання навіть високих доз ІНКО обумовлена доброю керованістю і передбачуваністю ефекту. Разом з тим, у разі використання off-label на це слід отримати окрему інформовану згоду пацієнта.
5.5. Інформована згода пацієнта
Лікар, який проводить ботулінотерапію повинен отримати інформовану згоду пацієнта перед ін’єкцією БНТ-А. Рекомендується за можливості інформувати пацієнтів та/або їх опікунів, коли заплановане лікування є off-label [88]. Однак ця інформація може бути складною для сприйняття пацієнтів із когнітивними/комунікативними проблемами. Пацієнти повинні отримувати письмову інформацію про використання БНТ-А, у бланку інформованої згоди повинен бути номер телефону для зручного спілкування з закладом охорони здоров’я або лікарем.
5.6. Тривалість ефекту та повторні введення БНТ-А
Відновлення здатності м’яза до скорочення відбувається поступово. Темпи цього відновлення залежать від швидкості розростання нервових за-кінчень (спраутінг), формування нових нервово-м’язових синапсів, відновлення транспортних білків пресинаптичної мембрани, «дозрівання» нервово-м’язової передачі. Клінічно значущий ефект може зберігатися 3-6-12 місяців [49].
Необхідність у повторних ін’єкціях БНТ-А виникає в середньому через 3 місяці після ін’єкції [75, 111, 123] .
6. Індивідуальний підхід при виборі стратегії ботулінотерапії
6.1. Критерії відбору пацієнтів
При встановленні діагнозу фокальної (мультифокальної) спастичності, після усунення чинників, які можуть провокувати чи підсилювати спастичність (див. розділ 4), необхідно прийняти рішення про доцільність застосування БНТ-А. Це рішення має базуватись на встановлених спільно з пацієнтом/доглядальником у SMART форматі цілях – активних чи пасивних. Окремо слід розглянути застосування БНТ-А з метою полегшення больового синдрому, зменшення мимовільних рухів та профілактики деформацій і контрактур.
При формуванні цілей відповідно до запиту пацієнта/доглядальника щодо верхньої кінцівки важливою є стратифікація пацієнтів на групи відновлення з використанням алгоритму PREP2 (див. розділ 4).
Застосування БНТ-А слід розглядати у випадках, якщо спастичність призводить до наступних порушень:
- Спазми у м’язах, що викликають:
– Біль,
– Втому,
– Складнощі з сидінням та поставою;
- Патологічне положення тулуба та кінцівок, що формує:
– Контрактури,
– Деформації кінцівок,
– Виразки тиску (пролежні) або інші проблеми з життєздатністю тканин;
- Біль, який тягне за собою:
– Виснаження та поганий настрій,
– Поганий сон;
- Втрата активної функції:
– Зменшена рухливість та спритність,
– Проблеми з сексуальною активністю,
– Труднощі з захопленням та маніпулюванням предметами;
- Втрата пасивної функції:
– Проблеми з доглядом та гігієною,
– Збільшене навантаження на доглядальника,
– Складнощі з сидінням у візку або позиціюванням в ліжку.
Не потрібно відразу виставляти багато цілей, особливо у випадку мультифокальної спастичності (важливо визначити пріоритети відповідно до потреб та очікувань пацієнта/доглядальника). Має значення особистий досвід лікаря та пацієнта [54]. Немає чітких обмежень у часі, коли вже не слід використовувати БНТ-А, лише індивідуальний підхід дає можливість прогнозувати користь та ефективність.
6.2. Визначення цільових м’язів
- Знання функціональної анатомії та дії м’язів є основним.
- Необхідна оцінка участі та значущості кожного м’язу у формуванні функціонального порушення та/або патологічної установки.
- Чітке розуміння понять: спастичність, селективний вольовий моторний контроль, слабкість.
- Вибір м’язу та порядок/пріоритет лікування узгоджується мультидисциплінарною командою залежно від поставлених цілей.
Перш за все, необхідно визначити перелік м’язів, які можуть бути залучені у функціональні порушення та/або формування патологічної установки. На наступному етапі необхідно оцінити внесок кожного м’язу в порушення функції. Важливим є розмежування понять спастичність, сила м’язу (парез-плегія) та СВМК. Кожен з цих параметрів оцінюється за окремою шкалою. Це дозволяє створити перелік цільових м’язів для введення БНТ-А. Розрізняти спастичність та слабкість принципово, оскільки обидві призводять до деформації кінцівки, однак їх лікування суттєво відрізняється [98]. Потрібно враховувати, що зменшення спастичності не призведе безпосередньо до зміни рівня СВМК. Порядок та пріоритет лікування визначаються залежно від поставлених цілей.
6.3. Обрахування оптимальної дози БНТ-А
Доза БНТ-А обчислюється на підставі стандартної таблиці доз для кожного окремого м’язу.
Оптимальна доза та кількість точок введення мають визначатись індивідуально, базуючись на:
- Розмірі, кількості та розташуванні задіяних м’язів,
- Виразності спастичності в кожному цільовому м’язі,
- Наявності локальної м’язової слабкості,
- «Відповіді» пацієнта на попереднє лікування (якщо таке було).
Багато точок введення дозволяє препарату більш рівномірно контактувати із зонами іннервації м’язу, що суттєво при ін’єкції у великі м’язи. Звичайна практика – починати з малих доз з поступовим підвищенням. Виразність та тривалість ефекту, в певній мірі, дозозалежні. Враховуючи те, що м’язи, в які було введено БНТ-А, відновлюють свою активність, є ймовірність необхідності повторної ін’єкції. Повторні курси ін’єкцій зазвичай потребують перегляду доз та цільових м’язів, а також обов’язкового повторного курсу реабілітації. Тому важливим є заповнення протоколу лікування із зазначенням цільових м’язів та доз введення: як сумарної, так і на кожний окремий м’яз.
6.4. Підготовка до введення БНТ-А: зберігання, відновлення, розведення, знеболення, техніка виконання ін’єкції
В Україні ОНА доступний у флаконах 100 од, ІНКО – 50 та 100 од, а АБО у флаконах по 300 і 500 од. Зберігаються невідкриті флакони відповідно до інструкції виробника:
- ОНА та АБО при температурі від 2 до 8°C;
- ОНА можна зберігати при –5°C або нижче;
- АБО не слід заморожувати;
- ІНКО зберігають при кімнатній температурі (не вище 25°C).
Препарати БНТ-А відновлюють фізіологічним розчином. Зазвичай застосовується легке, делікатне струшування, оскільки механічні фактори потенційно шкодять структурі та ефективності токсину [119]. В одному дослідженні дійшли висновку, що агресивне струшування та використання голок малого діаметру може пошкодити БНТ-А [34]. При наборі невеликий об’єм БНТ-А залишається у флаконі: при використанні голки 21G можна обмежити втрати до 2,3–4,6 од/флакон (при розведенні 100 од/1 мл) [87]. Є окремі рекомендації видаляти пробку з флакона для забору максимального об’єму БНТ-А, але при цьому необхідно враховувати ризик забруднення розчину або пошкодження флакону [39].
Залежно від об’єму розчинника, який використовується для відновлення БНТ-А, можна отримати більш чи менш концентрований розчин. Для ін’єкції у великі м’язи доцільно використовувати більші розведення, ніж для малих м’язів, оскільки при використанні на малих м’язах великі об’єми можуть призводити до небажаних ефектів (витікання, надмірна дифузія). Спрямування на кінцеві пластини може покращити ефективність ін’єкції. В певних м’язах кінцеві пластини виражені погано або розташовані дифузно, що може потребувати більше точок введення. Також, може бути корисним врахування структури м’язу при його візуалізації за допомогою ультразвуку під час введення.
Охолодження шкіри з використанням пакетів із льодом для знеболення та зменшення дискомфорту під час введення БНТ-А є найефективнішим. Довірливі відносини між лікарем та пацієнтом також можуть зменшити дискомфорт. У окремих випадках (мультифокальна, груба спастичність, тяжкий когнітивний дефіцит) виконання ін’єкцій БНТ-А може виконуватись під загальною анестезією.
Для введення препарату зручно використовувати туберкулінові шприци зі змінною голкою (заміна на 21–23 G). Шкала туберкулінових шприців зручна в роботі, дозволяє досить точно дозувати малі об’єми препарату. Доцільно набирати в окремий шприц необхідну для кожного м’язу або точки введення кількість препарату. В такому випадку, у разі відновлення 100 од БНТ-А на 1 мл фізіологічного розчину, можна легко збільшити об’єм при потребі. Не рекомендується вводити більше 50 од БНТ-А в одну точку.
Зазвичай пацієнт займає положення сидячи або лежачи. Перед введенням ділянка майбутніх ін’єкцій обробляється антисептичним розчином, що не містить алкоголю (наприклад, розчином хлоргексидину). Ін’єкції БНТ-А проводять після повного висихання поверхні шкіри. Для забезпечення цільової доставки ботулотоксину до запланованого м’язу важливим є використання інструментальних методів навігації. Реабілітаційні заходи можна розпочинати чи продовжувати відразу після виконання ін’єкцій БНТ-А.
6.5. Використання методів навігації при виконанні ін’єкції БНТ-А
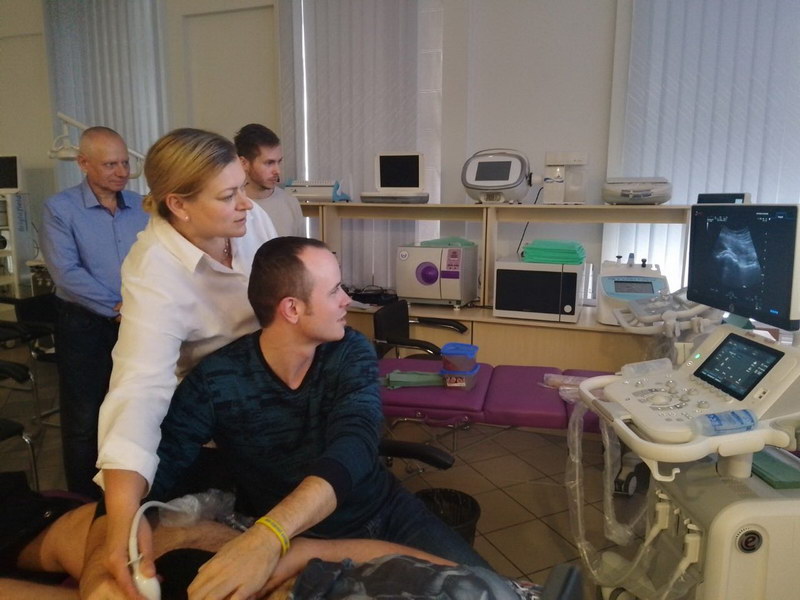
Правильне визначення ураженого м’язу та прицільне введення в нього БНТ-А – це ключ до успіху в лікуванні спастичності. У кількох клінічних дослідженнях оцінювали чотири методики скерування ін’єкцій: розміщення голки за анатомічними орієнтирами (АО), електростимуляція (ЕС), електроміографія (ЕМГ) та візуалізація за допомогою ультразвуку (УЗ). Визначення м’язу за АО неточне для всіх м’язів [22, 95, 104, 135]. Більшість досліджень продемонстрували, що інструментальне направлення (ЕМГ, ЕС або УЗ та їх поєднання) підвищує точність введення [51]. Ультразвукова навігація має ряд переваг, оскільки є неінвазивною методикою, не вимагає додаткового дорогого обладнання (спеціального електроду/голки) і, найголовніше, забезпечує достатню візуалізацію м’язів, в тому числі з діагностичною метою (структурні зміни). Водночас, метод УЗ-супроводу легкий у використанні, безболісний (на відміну від ЕМГ та ЕС ), дає змогу чітко визначити потрібний м’яз, візуалізує анатомічні структури, яких потрібно уникати (судини, нерви), забезпечує можливість бачити голку та процес введення БМТ-А.
Ін’єкцію під контролем УЗ можна проводити двома способами – у площині (in plain), коли голка проводиться паралельно до поверхні датчика, і її повністю видно на зображенні, та поза площиною (out of plain), коли видно тільки зріз голки. Введення розчину БНТ-А чітко видно на ультразвуковому зображенні, тому в разі сумнівів можна ввести невелику кількість медикаменту, переконатися, що голка перебуває в запланованому місці та продовжити ін’єкцію.
Дезінфекція шкіри поводиться антисептичними засобами без вмісту алкоголю. Використання бактеріостатичного гелю для УЗ під час ін’єкцій повністю безпечне.
6.6. Причини неефективності ботулінотерапії та їх корекція
Використання БНТ-А у лікуванні післяінсультної спастичності продемонструвало високу ефективність у зменшенні м’язового тонусу, полегшенні виконання базових функціональних завдань та усуненні болю.
Незадовільною реакцією на лікування (неефективним лікуванням) вважають суб’єктивну чи об’єктивну відсутність поліпшення або наявність виражених побічних ефектів під час лікування БНТ-А [32].
Розрізняють два основні види відсутності відпові-ді (ВВ) на лікування:
1) первинна ВВ (ПВВ) – лікування БНТ-А ніколи не
допомагало, тобто ефект був менше 25% від очікуваного після 2–3 послідовних циклів ін’єкцій у дозах, що зростали.
2) вторинна ВВ (ВВВ) – незадовільна реакція на два послідовних цикли ін’єкцій після щонайменше одного успішного циклу лікування.
Втрата ефективності може бути частковою або повною [97]. Зазвичай ефективність терапії знижується поступово, починаючи зі скорочення тривалості клінічного ефекту до повної відсутності відповіді на лікування [35, 124].
Недостатня ефективність лікування БНТ-А може бути обумовлена одним або кількома з наступних чинників:
- недостатня доза БНТ-А;
- неправильний вибір м’язів;
- неправильна техніка введення чи навігації;
- неправильне зберігання БНТ-А;
- побічні ефекти;
- імунорезистентність.
Деякі пацієнти частково або зовсім не відповідають на введення БНТ-А. Для оцінки чутливості пацієнта до БНТ-А можуть бути використані кілька клінічних чи лабораторних тестів. Клінічні тести надають чіткі докази наявності чи відсутності клінічної реакції на БНТ-А. Вони прості у виконанні та відносно недорогі. Їх результати можуть бути більш корисними ніж лабораторні дослідження. Найбільш популярними серед них є однобічний брівний тест (Unilateral brow injection – UBI) та лобний тест (Frontalis antibody test – FTAT). Суть їх полягає у введенні ботулінічного нейротоксину в m. corrugator або m. frontalis з одного боку. Парез в місці ін’єкції свідчить про відсутність резистентності, тобто про хорошу чутливість до БНТ-А. В такому випадку потрібно переглянути схему лікування спастичності (вибір цільових м’язів, дози препарату та техніки введення БНТ-А) [8].
Відсутність парезу в місці введення токсину свід-чить про резистентність до БНТ-А. Основними чинниками розвитку імунорезистентності можуть бути:
- високі дози на одну ін’єкцію та значні кумулятивні дози;
- склад деяких препаратів ботулотоксину (утворення антитіл є найбільш імовірним при високому вмісті білка);
- короткі інтервали між ін’єкціями, особливо «бустерні» ін’єкції, які робили через 1–2 тижні після основного циклу лікування.
Проте, слід зазначити, що дослідження, проведені з ІНКО демонструють можливості використання гнучкого індивідуального графіку ін’єкцій зі скороченим інтервалом та збільшенням дози препарату без утворення нейтралізуючих антитіл [37, 43, 56].
6.7. Профілактика та лікування побічних ефектів БНТ-А має сприятливий профіль безпеки. Побічні ефекти найчастіше бувають легкими та минають самостійно, зазвичай уже протягом двох тижнів [23]. Усі зареєстровані лікарські форми БНТ-А (ОНА-, АБО-, ІНКО не мають значимих відмінностей за профілем небажаних явищ.
Побічні ефекти ботулінотерапії можна розділити на три групи:
1. Побічні ефекти, що пов’язані з технікою проведення ін’єкції.
2. Побічні ефекти, що пов’язані з місцевими фармакологічними ефектами.
3. Побічні ефекти, що пов’язані із системним фармакологічним впливом препаратів БНТ-А на нер-вово-м’язові з’єднання інших м’язів і холінергічні синапси вегетативної нервової системи.
Що стосується побічних ефектів, пов’язаних із технікою виконання ін’єкції, можуть виникати локальна болючість і крововиливи, шкірні інфекції в разі порушення правил антисептики, а також травматизація голкою життєво важливих структур (нервів, судин) в разі некваліфікованого виконання процедури. Щоб уникнути цих ускладнень, ін’єкції БНТ-А повинен проводити висококваліфікований лікар, який має спеціальну підготовку і дозвіл від компанії-виробника.
Побічні ефекти, що пов’язані з місцевими фармакологічними ефектами БНТ-А, включають надмірну слабкість м’язів-мішеней і парез сусідніх м’язів. Їх клінічний прояв різноманітний залежно від місця введення БНТ-А.
Парез сусідніх м’язів розвивається у разі неточного введення БНТ-А в цільові м’язи та внаслідок дифузії. На ризик проникнення токсину у сусідні м’язи можуть впливати не тільки техніка ін’єкцій, але й застосована доза, концентрація, об’єм уведеного токсину. Ін’єкція БНТ-A в низьких концентраціях і великих об’ємах може призводити до більшої дифузії та більшої площі розподілу медикаменту. Надмірна слабкість м’язів-мішеней пов’язана з уведенням високих доз БНТ-А і також залежить від його об’єму. Збільшення об’єму ін’єкції токсину в п’ять разів зі збереженням дози токсину забезпечує збільшення хемоденервації на 50% у відповідній ділянці.
Основні системні побічні ефекти БНТ-А включають м’язову слабкість, дихальну недостатність, «грипоподібний» синдром, сухість у роті. Пригнічення холінергічних рецепторів глотки і гортані через системне поширення БНТ-А може бути однією з причин дисфагії та дисфонії. БНТ-А також може викликати такі вегетативні ефекти як жовчна колька, порушення вегетативної регуляції шлунково-кишкового тракту і серцево-судинної системи, пригнічення вегетативних холінергічних шляхів у сечовому міхурі. Ці системні побічні ефекти рідкісні та спостерігаються тільки при використанні високих доз або у пацієнтів із супутніми захворюваннями, що сприяють розвитку таких ускладнень.
Не можна забувати і про можливі алергічні реакції, зокрема анафілаксію, через алергію на компоненти, що наявні як допоміжні речовини в препаратах БНТ.
Заходи запобігання та мінімізації побічних ефектів:
1) точна локалізація ін’єкцій, застосування методів навігації;
2) використання найнижчої ефективної дози (необхідно знайти тонкий баланс між досягненням оптимальної ефективності та уникненням небажаних явищ);
3) застосування відповідних доз для кожного м’яза (для будь-яких м’язів, ослаблених після попередньої процедури, рекомендовано застосовувати знижену дозу);
4) після проведення ін’єкції, особливо першої, протягом години пацієнт має перебувати під наглядом лікаря для контролю за розвитком гострих алергічних реакцій.
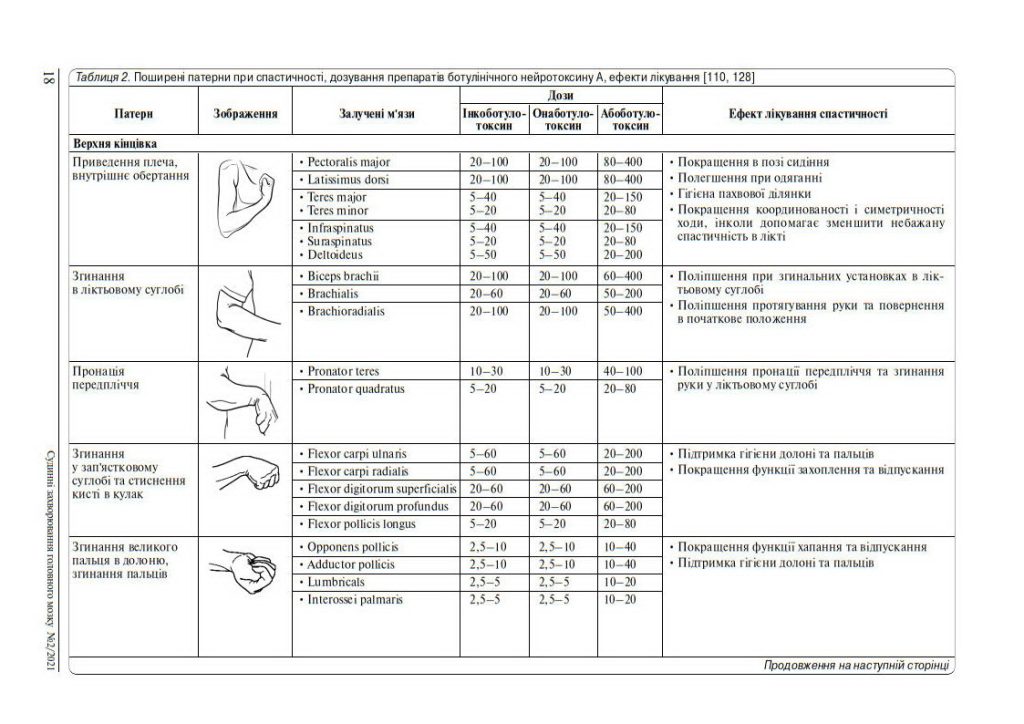
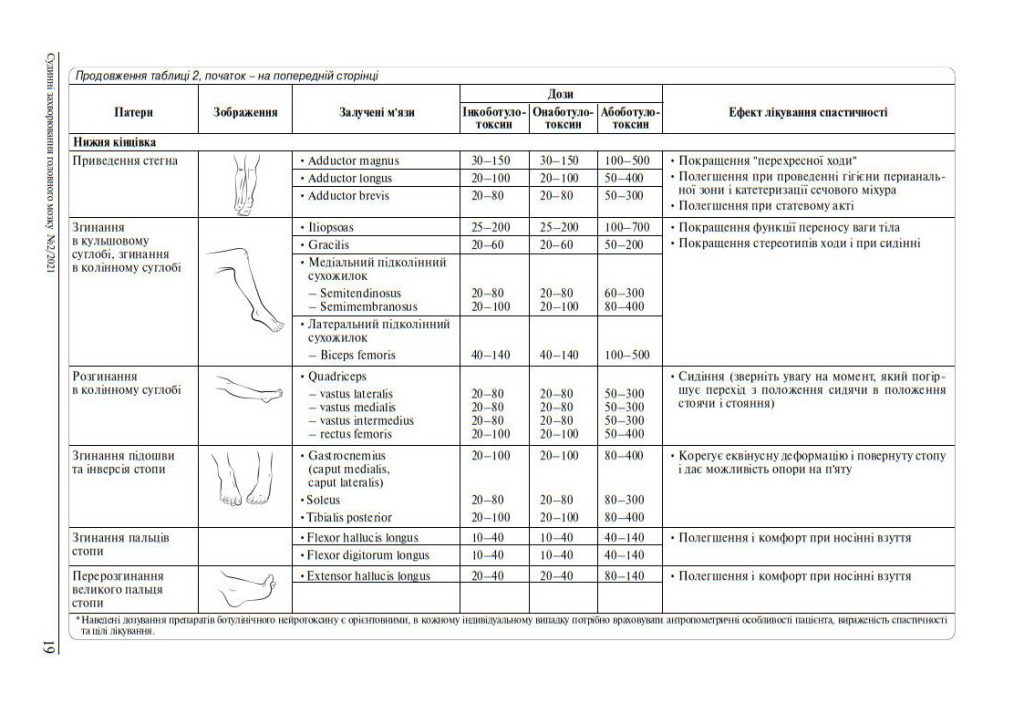
7. Основні патерни спастичності, дози БНТ-А
Вибір доз та мішеней для БНТ-А залежить від особливостей патологічного патерну спастичної кінцівки (таблиці 2).
Висновки
Спастичність залишається одним з ключових елементів синдрому ураження верхнього мотонейрону. Її не слід розглядати ізольовано. Лікування описаної патології спрямоване на відновлення функції, а не лише на зменшення спастичності. Тому важлива розробка чіткої індивідуальної стратегії лікування. Такий підхід у веденні пацієнта доцільний та виправданий для мультидисциплінарної команди. Своєчасне використання БНТ-А у поєднанні з фізичною терапією дозволяє зменшити спастичність, розширити реабілітацій-ні можливості та покращити якість життя пацієнта.
Дане наукове положення щодо практичних аспектів застосування БНТ-А рекомендоване для працівників сфери охорони здоров’я.
Література
1. Ada L, O’Dwyer N, O’Neill E. Relation between spasticity, weakness and contracture of the elbow flexors and upper limb activity after stroke: an observational study. Disabil Rehabil. 2006; 28 (13-14): 891-7. doi: 10.1080/09638280500535165.
2. Ageranioti S.A. Effect of vibration on hypertonia and hyperreflexia in the wrist joint of patients with spastic hemiparesis. Physiother Can. 1990; 42 (1): 24-33.
3. Angulo-Parker FJ, Adkinson JM. Common Etiologies of Upper Extremity Spasticity. Hand Clin. 2018; 34 (4): 437-443. doi: 10.1016/j.hcl.2018.06.001.
4. Ansari NN, Naghdi S, Arab TK, Jalaie S. The interrater and intrarater reliability of the Modified Ashworth Scale in the assess-ment of muscle spasticity: limb and muscle group effect. NeuroRehabilitation. 2008; 23 (3): 231-7.
5. Autti-Rämö I, Suoranta J, Anttila H, Malmivaara A, Mäkelä M. Effectiveness of upper and lower limb casting and orthoses in chil-dren with cerebral palsy: an overview of review articles. Am J Phys Med Rehabil. 2006; 85 (1): 89-103. doi: 10.1097/01.phm. 0000179442.59847.27.
6. Baricich, A., Picelli, A., Santamato, A. et al. Safety Profile of High-Dose Botulinum Toxin Type A in Post-Stroke Spasticity Treatment. Clin Drug Investig 2018; 38: 991-1000. doi:10.1007/s40261-018-0701-x
7. Barnes M, Kocer S, Murie Fernandez M, Balcaitiene J, Fheodoroff K. An international survey of patients living with spasticity. Disabil Rehabil. 2017; 39 (14): 1428-1434. doi: 10.1080/09638288.2016. 1198432.
8. Bellows S, Jankovic J. Immunogenicity Associated with Botulinum Toxin Treatment. Toxins (Basel). 2019; 11 (9): 491. doi: 10.3390/ toxins11090491.
9. Bensmail D, Hanschmann A, Wissel J. Satisfaction with botulinum toxin treatment in post-stroke spasticity: results from two cross-sectional surveys (patients and physicians). J Med Econ. 2014 Sep; 17(9):618-25. doi: 10.3111/13696998.2014.925462. Epub 2014 Jun 12. PMID: 24841450.
10. Bobath B. Adult Hemiplegia Evaluation and Treatment, 3rd Edition. Butterworth-Heinemann. 1990; 208 p.
11. Bohannon RW, Smith MB. Interrater reliability of a modified Ashworth scale of muscle spasticity. Phys Ther. 1987; 67 (2): 206-7. doi: 10.1093/ptj/67.2.206.
12. Bowman J, Mogensen L, Marsland E, Lannin N. The development, content validity and inter-rater reliability of the SMART-Goal Evaluation Method: A standardised method for evaluating clinical goals. Aust Occup Ther J. 2015; 62 (6): 420-7. doi: 10.1111/1440-1630. 12218.
13. Boyd R. N., Graham H. K. Botulinum toxin A in the management of children with cerebral palsy: indications and outcome. Eur J Neurol. 1997; 4 (suppl. 2): S15-S22.
14. Brashear A, Gordon MF, Elovic E, Kassicieh VD, Marciniak C, Do M, Lee CH, Jenkins S, Turkel C; Botox Post-Stroke Spasticity Study Group. Intramuscular injection of botulinum toxin for the treatment of wrist and finger spasticity after a stroke. N Engl J Med. 2002; 347 (6): 395-400. doi: 10.1056/NEJMoa011892.
15. Burdett RG, Habasevich R, Pisciotta J, Simon SR. Biomechanical comparison of rising from two types of chairs. Phys Ther. 1985; 65 (8): 1177-83. doi: 10.1093/ptj/65.8.1177.
16. Burke D, Wissel J, Donnan GA. Pathophysiology of spasticity in stroke. Neurology. 2013; 80 (3 Suppl 2): S20-6. doi: 10.1212/WNL. 0b013e31827624a7.
17. Burridge JH, Wood DE, Hermens HJ, Voerman GE, Johnson GR, van Wijck F, Platz T, Gregoric M, Hitchcock R, Pandyan AD. Theoretical and methodological considerations in the measurement of spasticity. Disabil Rehabil. 2005; 27 (1-2): 69-80. doi: 10.1080/ 09638280400014592.
18. Cahill-Rowley K, Rose J. Etiology of impaired selective motor control: emerging evidence and its implications for research and treatment in cerebral palsy. Dev Med Child Neurol. 2014; 56 (6): 522-8. doi: 10.1111/dmcn.12355.
19. Canning CG, Shepherd RB, Carr JH, Alison JA, Wade L, White A. A randomized controlled trial of the effects of intensive sit-to-stand training after recent traumatic brain injury on sit-to-stand perform-ance. Clin Rehabil. 2003; 17 (4): 355-62. doi: 10.1191/ 0269215503cr620oa.
20. Charles J, Gordon AM. A critical review of constraint-induced movement therapy and forced use in children with hemiplegia. Neural Plast. 2005; 12 (2-3): 245-61; discussion 263-72. doi: 10.1155/NP.2005.245.
21. Charles JR, Wolf SL, Schneider JA, Gordon AM. Efficacy of a child-friendly form of constraint-induced movement therapy in hemiplegic cerebral palsy: a randomized control trial. Dev Med Child Neurol. 2006; 48 (8): 635-42. doi: 10.1017/S0012162206001356.
22. Chin TY, Duncan JA, Johnstone BR, Graham HK. Management of the upper limb in cerebral palsy. J Pediatr Orthop B. 2005; 14 (6): 389-404. doi: 10.1097/01202412-200511000-00001.
23. Chiu SY, Patel B, Burns MR, Legacy J, Wagle Shukla A, Ramirez-Zamora A, Deeb W, Malaty IA. High-dose Botulinum Toxin Therapy: Safety, Benefit, and Endurance of Efficacy. Tremor Other Hyperkinet Mov (N Y). 2020; 10. doi: 10.7916/tohm.v0.749.
24. Clarke NM, Camba GC, Stephens JM, Pulgar S, Bains S, Marchese D, Tilton AH. Poster 479 Economic Burden of Pediatric Spasticity in Cerebral Palsy: A Review of the Literature. PM R. 2016; 8 (9S): S316. doi: 10.1016/j.pmrj.2016.07.398.
25. Clinical Guidelines for Stroke Management [Електронний ресурс]. -2021. — Режим доступу до ресурсу: https://app.magicapp.org/#/ guideline/WE8wOn/section/ERRp1E. Accessed [02.09.2021] Chapter 6: Managing complications.
26. Crone C, Petersen NT, Gimenéz-Roldán S, Lungholt B, Nyborg K, Nielsen JB. Reduced reciprocal inhibition is seen only in spastic limbs in patients with neurolathyrism. Exp Brain Res. 2007; 181 (1): 193-7. doi: 10.1007/s00221-007-0993-1.
27. Damiano DL, Vaughan CL, Abel MF. Muscle response to heavy resistance exercise in children with spastic cerebral palsy. Dev Med Child Neurol. 1995; 37 (8): 731-9. doi: 10.1111/j.1469-8749.1995. tb15019.x.
28. Dietz V. Spastic movement disorder: what is the impact of research on clinical practice? J Neurol Neurosurg Psychiatry. 2003; 74( 6): 820-1. doi: 10.1136/jnnp.74.6.820-a.
29. Ditunno JF, Little JW, Tessler A, Burns AS. Spinal shock revisited: a four-phase model. Spinal Cord. 2004; 42 (7): 383-95. doi: 10.1038/ sj.sc.3101603.
30. Dornák T, Justanová M, Konvalinková R, Ríha M, Mu ík J, Hoskovcová M, Srp M, Navrátilová D, Otruba P, Gál O, Svobodová I, Dušek L, Bareš M, Kanovský P, Jech R. Prevalence and evolution of spasticity in patients suffering from first-ever stroke with carotid ori-gin: a prospective, longitudinal study. Eur J Neurol. 2019; 26 (6): 880-886. doi: 10.1111/ene.13902.
31. Doussoulin A, Rivas C, Bacco J, Sepúlveda P, Carvallo G, Gajardo C, Soto A, Rivas R. Prevalence of Spasticity and Postural Patterns in the Upper Extremity Post Stroke. J Stroke Cerebrovasc Dis. 2020; 29 (11): 105253. doi: 10.1016/j.jstrokecerebrovasdis.2020.105253.
32. Dressler D. Clinical presentation and management of antibody-induced failure of botulinum toxin therapy. Mov Disord. 2004; 19 Suppl 8: S92-S100. doi: 10.1002/mds.20022.
33. Dressler D. Routine use of Xeomin in patients previously treated with Botox: long term results. Eur J Neurol. 2009; 16 Suppl 2: 2-5. doi: 10.1111/j.1468-1331.2009.02877.x.
34. Dressler D, Altenmueller E, Bhidayasiri R, Bohlega S, Chana P, Chung TM, et al. Strategies for treatment of dystonia. J Neural Transm 2016; 123: 251-258.
35. Dressler D, Bigalke H. Immunological aspects of botulinum toxin therapy. Expert Rev Neurother. 2017; 17 (5): 487-494. doi: 10.1080/ 14737175.2017.1262258.
36. Dressler D, Bhidayasiri R, Bohlega S, Chana P, Chien HF, Chung TM, Colosimo C, Ebke M, Fedoroff K, Frank B, Kaji R, Kanovsky P, Koçer S, Micheli F, Orlova O, Paus S, Pirtosek Z, Relja M, Rosales RL, Sagástegui-Rodríguez JA, Schoenle PW, Shahidi GA, Timerbaeva S, Walter U, Saberi FA. Defining spasticity: a new approach considering current movement disorders terminology and botulinum toxin therapy. J Neurol. 2018; 265 (4): 856-862. doi: 10.1007/s00415-018-8759-1.
37. Dressler D, Pan L, Adib Saberi F. Antibody-induced failure of botulinum toxin therapy: re-start with low-antigenicity drugs offers a new treatment opportunity. J Neural Transm (Vienna). 2018; 125 (10): 1481-1486. doi: 10.1007/s00702-018-1911-3.
38. Durkin MS, Benedict RE, Christensen D, Dubois LA, Fitzgerald RT, Kirby RS, Maenner MJ, Van Naarden Braun K, Wingate MS, Yeargin-Allsopp M. Prevalence of Cerebral Palsy among 8-Year-Old Children in 2010 and Preliminary Evidence of Trends in Its Relationship to Low Birthweight. Paediatr Perinat Epidemiol. 2016; 30 (5): 496-510. doi: 10.1111/ppe.12299.
39. Dykstra DD, Wieting JM, McGuire J, Kowalkowski T. Maximizing extraction of botulinum toxin type A from vials. Arch Phys Med Rehabil 2002; 83: 1638-1640.
40. Elbasiouny SM, Moroz D, Bakr MM, Mushahwar VK. Management of spasticity after spinal cord injury: current techniques and future directions. Neurorehabil Neural Repair. 2010; 24 (1): 23-33. doi: 10.1177/1545968309343213.
41. Eldred E, Granit R, Merton PA. Supraspinal control of the muscle spindles and its significance. J Physiol. 1953; 122 (3): 498-523. doi: 10.1113/jphysiol.1953.sp005017.
42. Eliasson AC, Krumlinde-sundholm L, Shaw K, Wang C. Effects of constraint-induced movement therapy in young children with hemi-plegic cerebral palsy: an adapted model. Dev Med Child Neurol. 2005; 47 (4): 266-75. doi: 10.1017/s0012162205000502.
43. Evidente VGH, Fernandez HH, LeDoux MS et al. A randomized, double-blind study of repeated incobotulinum toxin A (Xeomin®) in cervical dystonia. J Neural Trans. 2013; 120 (12): 1699-1707
44. Flanigan M, Gaebler-Spira D, Kocherginsky M, Garrett A, Marciniak C. Spasticity and pain in adults with cerebral palsy. Dev Med Child Neurol. 2020; 62 (3): 379-385. doi: 10.1111/dmcn.14368.
45. Frevert J. Content of botulinum neurotoxin in Botox®/Vistabel®, Dysport®/Azzalure®, and Xeomin®/Bocouture®. Drugs R D. 2010; 10 (2): 67-73. doi:10.2165/11584780-000000000-00000
46. Fridén J, House J, Keith M, Schibli S, van Zyl N. Improving hand function after spinal cord injury. J Hand Surg Eur Vol. 2021 Jul 13:17531934211027460. doi: 10.1177/17531934211027460. Epub ahead of print.
47. Ganapathy V, Graham GD, DiBonaventura MD, Gillard PJ, Goren A, Zorowitz RD. Caregiver burden, productivity loss, and indirect costs associated with caring for patients with poststroke spasticity. Clin Interv Aging. 2015; 10: 1793-802. doi: 10.2147/CIA.S91123.
48. Ganguly J, Kulshreshtha D, Almotiri M, Jog M. Muscle Tone Physiology and Abnormalities. Toxins (Basel). 2021; 13 (4): 282. doi: 10.3390/toxins13040282.
49. Gracies JM, Brashear A, Jech R, McAllister P, Banach M, Valkovic P, Walker H, Marciniak C, Deltombe T, Skoromets A, Khatkova S, Edgley S, Gul F, Catus F, De Fer BB, Vilain C, Picaut P; International Abobotulinumtoxin A Adult Upper Limb Spasticity Study Group. Safety and efficacy of abobotulinumtoxinA for hemi-paresis in adults with upper limb spasticity after stroke or traumatic brain injury: a double-blind randomised controlled trial. Lancet Neurol. 2015; 14 (10): 992-1001. doi: 10.1016/S1474-4422(15)00216-1.
50. Graham LA. Management of spasticity revisited. Age Ageing. 2013; 42 (4): 435-41. doi: 10.1093/ageing/aft064. PMID: 23775030.
51. Grigoriu AI, Dinomais M, Rémy-Néris O, Brochard S. Impact of injection-guiding techniques on the effectiveness of botulinum toxin for the treatment of focal spasticity and dystonia: a systematic review. Arch Phys Med Rehabil 2015; 96: 2067-2078.
52. Groth H. R., Novak S. E. Examination of the Reliability and Validity of Rancho Los Amigos Observational Gait Analysis. Grand Valley State University, 1999.
53. Hakkennes S, Keating JL. Constraint-induced movement therapy following stroke: a systematic review of randomised controlled trials. Aust J Physiother. 2005; 51 (4): 221-31. doi: 10.1016/s0004-9514(05)70003-9.
54. Harriss J, Simon O, Li J, Ellers-Lenz B, Roche N, Cantú-Brito C, et al. Physician characteristics in an international, non-interventional study of botulinum toxin formulations in treatment-naїve patients with spasticity (SPACE). Ann Phys Rehabil Med 2014; 57: e47.
55. Harvey LA, Katalinic OM, Herbert RD, Moseley AM, Lannin NA, Schurr K. Stretch for the treatment and prevention of contracture: an abridged republication of a Cochrane Systematic Review. J Physiother. 2017; 63 (2): 67-75. doi: 10.1016/j.jphys.2017.02.014.
56. Hefter H, Brauns R, Ürer B, Rosenthal D, Albrecht P. Effective long-term treatment with incobotulinumtoxin (Xeomin®) without neu-tralizing antibody induction: a monocentric, cross-sectional study. J Neurol. 2020; 267 (5): 1340-1347. doi: 10.1007/s00415-019-09681-7.
57. Hoare B, Imms C, Carey L, Wasiak J. Constraint-induced movement therapy in the treatment of the upper limb in children with hemi-plegic cerebral palsy: a Cochrane systematic review. Clin Rehabil. 2007; 21 (8): 675-85. doi: 10.1177/0269215507080783.
58. Holtz KA, Lipson R, Noonan VK, Kwon BK, Mills PB. Prevalence and Effect of Problematic Spasticity After Traumatic Spinal Cord Injury. Arch Phys Med Rehabil. 2017; 98 (6): 1132-1138. doi: 10.1016/j.apmr.2016.09.124.
59. Ianieri G, Marvulli R, Gallo GA, Fiore P, Megna M. «Appropriate Treatment» and Therapeutic Window in Spasticity Treatment with IncobotulinumtoxinA: From 100 to 1000 Units. Toxins (Basel). 2018 Mar 28;10(4):140. doi: 10.3390/toxins10040140. PMID: 29597251; PMCID: PMC5923306.
60. Jankovic J, Albanese A, Attassi MZ, et al. Botulinum toxin therapeu-tic clinical practice and science. Philadelphia (PA): Saunders Elsevier; 2009.
61. Jia S, Liu Y, Shen L, Liang X, Xu X, Wei Y. Botulinum Toxin Type A for Upper Limb Spasticity in Poststroke Patients: A Meta-analysis of Randomized Controlled Trials. J Stroke Cerebrovasc Dis. 2020; 29 (6): 104682. doi: 10.1016j.jstrokecerebrovasdis.2020.104682.
62. Jin Y, Zhao Y. Post-stroke Upper Limb Spasticity Incidence for Different Cerebral Infarction Site. Open Med (Wars). 2018; 13: 227-231. doi: 10.1515/med-2018-0035.
63. Katalinic OM, Harvey LA, Herbert RD, Moseley AM, Lannin NA, Schurr K. Stretch for the treatment and prevention of contractures. Cochrane Database Syst Rev. 2010; (9): CD007455. doi: 10.1002/ 14651858.CD007455.pub2.
64. Lance JW. The control of muscle tone, reflexes, and movement: Robert Wartenberg Lecture. Neurology. 1980; 30 (12): 1303-13. doi: 10.1212/wnl.30.12.1303.
65. Landau WM. Editorial: Spasticity: the fable of a neurological demon and the emperor’s new therapy. Arch Neurol. 1974; 31 (4): 217-9. doi: 10.1001/archneur.1974.00490400031001.
66. Lannin N, Scheinberg A, Clark K. AACPDM systematic review of the effectiveness of therapy for children with cerebral palsy after bot-ulinum toxin A injections. Dev Med Child Neurol. 2006; 48 (6): 533-9. doi: 10.1017/S0012162206001125.
67. Leathley MJ, Gregson JM, Moore AP, Smith TL, Sharma AK, Watkins CL. Predicting spasticity after stroke in those surviving to 12 months. Clin Rehabil. 2004; 18 (4): 438-43. doi: 10.1191/ 0269215504cr727oa.
68. Li S, Francisco GE. New insights into the pathophysiology of post-stroke spasticity. Front Hum Neurosci. 2015; 9: 192. doi: 10.3389/fnhum.2015.00192.
69. Li S, Francisco GE, Rymer WZ. A New Definition of Poststroke Spasticity and the Interference of Spasticity With Motor Recovery From Acute to Chronic Stages. Neurorehabil Neural Repair. 2021; 35 (7): 601-610. doi: 10.1177/15459683211011214.
70. Lieber RL, Runesson E, Einarsson F, Fridén J. Inferior mechanical properties of spastic muscle bundles due to hypertrophic but compro-mised extracellular matrix material. Muscle Nerve. 2003; 28 (4): 464-71. doi: 10.1002/mus.10446.
71. MacPhail HE, Kramer JF. Effect of isokinetic strength-training on functional ability and walking efficiency in adolescents with cerebral palsy. Dev Med Child Neurol. 1995; 37 (9): 763-75. doi: 10.1111/ j.1469-8749.1995.tb12060.x.
72. Malhotra S, Pandyan AD, Day CR, Jones PW, Hermens H. Spasticity, an impairment that is poorly defined and poorly measured. Clin Rehabil. 2009; 23 (7): 651-8. doi: 10.1177/0269215508101747.
73. Mancini F, Sandrini G, Moglia A, Nappi G, Pacchetti C. A ran-domised, double-blind, dose-ranging study to evaluate efficacy and safety of three doses of botulinum toxin type A (Botox) for the treat-ment of spastic foot. Neurol Sci. 2005 Apr; 26(1):26-31. doi: 10.1007/s10072-005-0378-9. PMID: 15877184.
74. Martin A, Abogunrin S, Kurth H, Dinet J. Epidemiological, human-istic, and economic burden of illness of lower limb spasticity in adults: a systematic review. Neuropsychiatr Dis Treat. 2014; 10: 111-22. doi: 10.2147/NDT.S53913.
75. Mathevon L, Declemy A, Laffont I, Perennou D. Immunogenicity induced by botulinum toxin injections for limb spasticity: A system-atic review. Ann Phys Rehabil Med. 2019; 62 (4): 241-251. doi: 10.1016/j.rehab.2019.03.004.
76. McGuire J. Epidemiology of spasticity in the adult and child. In: Brashear A, Elovic E, editors. Spasticity, diagnosis and treatment. 1st edition. Demos-MEDICAL; 2011. p. 5-15
77. McLaughlin J, Bjornson K, Temkin N, Steinbok P, Wright V, Reiner A, Roberts T, Drake J, O’Donnell M, Rosenbaum P, Barber J, Ferrel A. Selective dorsal rhizotomy: meta-analysis of three randomized con-trolled trials. Dev Med Child Neurol. 2002; 44 (1): 17-25. doi: 10.1017/s0012162201001608.
78. McLellan DL. C0-contraction and stretch reflexes in spasticity dur-ing treatment with baclofen. J Neurol Neurosurg Psychiatry. 1977; 40 (1): 30-8. doi: 10.1136/jnnp.40.1.30.
79. McMorland AJ, Runnalls KD, Byblow WD. A neuroanatomical framework for upper limb synergies after stroke. Front Hum Neurosci. 2015 Feb 16; 9: 82. doi: 10.3389/fnhum.2015.00082.
80. Morris C. A review of the efficacy of lower-limb orthoses used for cerebral palsy. Dev Med Child Neurol. 2002; 44 (3): 205-11. doi: 10.1017/s0012162201001943.
81. Mukherjee A, Chakravarty A. Spasticity mechanisms — for the clini-cian. Front Neurol. 2010; 1: 149. doi: 10.3389/fneur.2010.00149.
82. Nair KP, Marsden J. The management of spasticity in adults. BMJ. 2014; 349: g4737. doi: 10.1136/bmj.g4737.
83. Nam KE, Lim SH, Kim JS, Hong BY, Jung HY, Lee JK, Yoo SD, Pyun SB, Lee KM, Lee KJ, Kim H, Han EY, Lee KW. When does spasticity in the upper limb develop after a first stroke? A nationwide observational study on 861 stroke patients. J Clin Neurosci. 2019; 66: 144-148. doi: 10.1016/j.jocn.2019.04.034.
84. Nathan PW. Treatment of spasticity with perineural injections of phenol. Dev Med Child Neurol. 1969; 11 (3): 384. doi: 10.1111/ j.1469-8749.1969.tb01453.x.
85. National Institute for Health and Care Excellence. Clinical Guidelines. In: Spasticity in under 19s: Management. London: National Institute for Health and Care Excellence (UK) Copyright (c) NICE 2018; 2016. www.nice.org.uk/guidance/cg145
86. Neilson PD, McCaughey J. Self-regulation of spasm and spasticity in cerebral palsy. J Neurol Neurosurg Psychiatry. 1982; 45 (4): 320-30. doi: 10.1136/jnnp.45.4.320.
87. Niamtu J. Neurotoxin waste from drawing product through the vial stopper. J Clin Aesthet Dermatol 2014; 7: 33-37.
88. Nicklin J. Improving the quality of written information for patients. Nurs Stand. 2002; 16 (49): 39-44. doi: 10.7748/ns2002.08.16.49.39.c3253. 89. Novak I, Morgan C, Fahey M, Finch-Edmondson M, Galea C, Hines A, Langdon K, Namara MM, Paton MC, Popat H, Shore B, Khamis A, Stanton E, Finemore OP, Tricks A, Te Velde A, Dark L, Morton N, Badawi N. State of the Evidence Traffic Lights 2019: Systematic Review of Interventions for Preventing and Treating Children with Cerebral Palsy. Curr Neurol Neurosci Rep. 2020; 20(2):
3. doi: 10.1007/s11910-020-1022-z.
90. Observational Gait Analysis. Los Amigos Research and Education Institute, Rancho Los Amigos National Rehabilitation Center, 2001. — 73 Р. 91. O’Dwyer NJ, Ada L, Neilson PD. Spasticity and muscle contracture following stroke. Brain. 1996; 119 (Pt 5): 1737-49. doi: 10.1093/brain/119.5.1737.
92. Ouellette MM, LeBrasseur NK, Bean JF, Phillips E, Stein J, Frontera WR, Fielding RA. High-intensity resistance training improves muscle strength, self-reported function, and disability in long-term stroke survivors. Stroke. 2004; 35 (6): 1404-9. doi: 10.1161/01.STR.0000127785.73065.34.
93. Park J, Lee MS, Harrison AR. Profile of Xeomin® (incobotulinumtoxinA) for the treatment of blepharospasm. Clin Ophthalmol. 2011; 5: 725-32. doi: 10.2147/OPTH.S13978.
94. Persson CU, Holmegaard L, Redfors P, Jern C, Blomstrand C, Jood K. Increased muscle tone and contracture late after ischemic stroke. Brain Behav. 2020; 10 (2): e01509. doi: 10.1002/brb3.1509.
95. Picelli A, Tamburin S, Bonetti P, Fontana C, Barausse M, Dambruoso F, et al. Botulinum toxin type a injection into the Gastrocnemius muscle for spastic Equinus in adults with stroke. Am J Phys Med Rehabil 2012; 91: 957-964.
96. Pictorial Atlas of Botulinum toxin Injection. Wolfgang Jost. 2011. 97. Rasetti-Escargueil C, Popoff MR. Antibodies and Vaccines against
Botulinum Toxins: Available Measures and Novel Approaches. Toxins (Basel). 2019; 11 (9): 528. doi: 10.3390/toxins11090528.
98. Richardson D, Greenwood R, Sheean G, Thompson A, Edwards S. Treatment of focal spasticity with botulinum toxin: effect on the ‘pos-itive support reaction’. Physiother Res Int. 2000;5(1):62-70; discus-sion 71-2. doi: 10.1002/pri.184. PMID: 10785911.
99. Rossetto O, Megighian A, Scorzeto M, Montecucco C. Botulinum neu-rotoxins. Toxicon. 2013; 67: 31-6. doi: 10.1016/j.toxicon. 2013.01.017.
100.Sahrmann SA, Norton BJ. The relationship of voluntary movement to spasticity in the upper motor neuron syndrome. Trans Am Neurol Assoc. 1977; 102: 108-12.
101.Sáinz-Pelayo MP, Albu S, Murillo N, Benito-Penalva J. Espasticidad en la patología neurológica. Actualización sobre mecanismos fisiopatológicos, avances en el diagnóstico y tratamien-to [Spasticity in neurological pathologies. An update on the patho-physiological mechanisms, advances in diagnosis and treatment]. Rev Neurol. 2020; 70 (12): 453-460. Spanish. doi: 10.33588/ rn.7012.2019474.
102.Santamato A, Panza F, Ranieri M, Frisardi V, Micello MF, Filoni S, Fortunato F, Intiso D, Basciani M, Logroscino G, Fiore P. Efficacy and safety of higher doses of botulinum toxin type A NT 201 free from complexing proteins in the upper and lower limb spasticity after stroke. J Neural Transm (Vienna). 2013
103.Santello M, Lang CE. Are movement disorders and sensorimotor injuries pathologic synergies? When normal multi-joint movement synergies become pathologic. Front Hum Neurosci. 2015; 8: 1050. doi: 10.3389/fnhum.2014.01050.
104.Schnitzler A, Roche N, Denormandie P, Lautridou C, Parratte B, Genet F. Manual needle placement: accuracy of botulinum toxin a injections. Muscle Nerve 2012; 46: 531-534.
105.Scott AB. Botulinum toxin injection into extraocular muscles as an alternative to strabism surgery. Ophtalmology. 1980; 87 (10): 1044-1049 106.Sherman SJ, Koshland GF, Laguna JF. Hyper-reflexia without spasticity after unilateral infarct of the medullary pyramid. J Neurol Sci. 2000; 175 (2): 145-55. doi: 10.1016/s0022-510x(00)00299-9. 107.Simpson DM, Hallett M, Ashman EJ, Comella CL, Green MW, Gronseth GS, Armstrong MJ, Gloss D, Potrebic S, Jankovic J, Karp BP, Naumann M, So YT, Yablon SA. Practice guideline update summa-ry: Botulinum neurotoxin for the treatment of blepharospasm, cer-vical dystonia, adult spasticity, and headache: Report of the Guideline Development Subcommittee of the American Academy of Neurology. Neurology. 2016; 86 (19): 1818-26. doi: 10.1212/ WNL.0000000000002560.
108.Smith MC, Ackerley SJ, Barber PA, Byblow WD, Stinear CM. PREP2 Algorithm Predictions Are Correct at 2 Years Poststroke for Most Patients. Neurorehabil Neural Repair. 2019; 33 (8): 635-642. doi: 10.1177/1545968319860481.
109.Sommerfeld DK, Eek EU, Svensson AK, Holmqvist LW, von Arbin MH. Spasticity after stroke: its occurrence and association with motor impairments and activity limitations. Stroke. 2004; 35 (1): 134-9. doi: 10.1161/01.STR.0000105386.05173.5E.
110.Spasticity in adults: management using botulinum toxin. National guidelines. London: Publisher: Royal College of Physicians, 2018.
111. Srinoulprasert Y, Wanitphakdeedecha R. Antibody-induced botulinum toxin treatment failure: A review and novel management approach. J Cosmet Dermatol. 2020; 19 (10): 2491-2496. doi: 10.1111/ jocd.13637.
112.Stevenson VL, Gras A, Bárdos JI, Broughton J. The high cost of spasticity in multiple sclerosis to individuals and society. Mult Scler. 2015; 21 (12): 1583-92. doi: 10.1177/1352458514566416.
113.Stinear CM, Byblow WD, Ackerley SJ, Smith MC, Borges VM, Barber PA. PREP2: A biomarker-based algorithm for predicting upper limb function after stroke. Ann Clin Transl Neurol. 2017; 4 (11): 811-820. doi:10.1002/acn3.488
114.Taub E, Ramey SL, DeLuca S, Echols K. Efficacy of constraint-induced movement therapy for children with cerebral palsy with asymmetric motor impairment. Pediatrics. 2004; 113 (2): 305-12. doi: 10.1542/peds.113.2.305.
115.Teixeira-Salmela LF, Olney SJ, Nadeau S, Brouwer B. Muscle strengthening and physical conditioning to reduce impairment and disability in chronic stroke survivors. Arch Phys Med Rehabil. 1999; 80 (10): 1211-8. doi: 10.1016/s0003-9993(99)90018-7.
116.The PREP2 prediction tool predicts functional outcomes for the upper limb. [Електронний ресурс] — Режим доступу до ресурсу: https://presto.auckland.ac.nz/.- Accessed [06.09.2021]
117.Thompson AJ, Jarrett L, Lockley L, Marsden J, Stevenson VL. Clinical management of spasticity. J Neurol Neurosurg Psychiatry. 2005; 76 (4): 459-63. doi: 10.1136/jnnp.2004.035972.
118.Toro B, Nester C, Farren P. A review of observational gait assess-ment in clinical practice. Physiotherapy Theory and Practice. 2003; 19 (3): 137-149, doi: 10.1080/09593980307964
119.Toth SI, Smith LA, Ahmed SA. Extreme sensitivity of botulinum neurotoxin domains towards mild agitation. J Pharm Sci. 2009; 98 (9): 3302-11. doi: 10.1002/jps.21676.
120.Wagner LV, Davids JR, Hardin JW. Selective Control of the Upper Extremity Scale: validation of a clinical assessment tool for children with hemiplegic cerebral palsy. Dev Med Child Neurol. 2016; 58 (6): 612-7. doi: 10.1111/dmcn.12949.
121.Walker TJ, Dayan SH. Comparison and overview of currently avail-able neurotoxins. J Clin Aesthet Dermatol. 2014; 7 (2): 31-9.
122.Wallmann HW. Introduction to Observational Gait Analysis. Home Health Care Management & Practice. 2009; 22 (1): 66-68. doi:10.1177/1084822309343277
123.Walter U, Mühlenhoff C, Benecke R, Dressler D, Mix E, Alt J, Wittstock M, Dudesek A, Storch A, Kamm C. Frequency and risk factors of antibody-induced secondary failure of botulinum neuro-toxin therapy. Neurology. 2020; 94 (20): e2109-e2120. doi: 10.1212/ WNL.0000000000009444. Erratum in: Neurology. 2020; 95 (17): 802.
124.Wanitphakdeedecha R, Kantaviro W, Suphatsathienkul P, Tantrapornpong P, Yan C, Apinumtham C, Srinoulprasert Y. Association Between Secondary Botulinum Toxin A Treatment Failure in Cosmetic Indication and Anti-Complexing Protein Antibody Production. Dermatol Ther (Heidelb). 2020; 10 (4): 707-720. doi: 10.1007/s13555-020-00397-5.
125.Ward AB. A literature review of the pathophysiology and onset of post-stroke spasticity. Eur J Neurol. 2012; 19 (1): 21-7. doi: 10.1111/j.1468-1331.2011.03448.x.
126.Wedekind C, Lippert-Grüner M. Long-term outcome in severe traumatic brain injury is significantly influenced by brainstem involvement. Brain Inj. 2005; 19 (9): 681-4. doi: 10.1080/ 02699050400025182.
127.Wiley ME, Damiano DL. Lower-extremity strength profiles in spas-tic cerebral palsy. Dev Med Child Neurol. 1998; 40 (2): 100-7. doi: 10.1111/j.1469-8749.1998.tb15369.x.
128.Winstein CJ, Stein J, Arena R, Bates B, Cherney LR, Cramer SC, Deruyter F, Eng JJ, Fisher B, Harvey RL, Lang CE, MacKay-Lyons M, Ottenbacher KJ, Pugh S, Reeves MJ, Richards LG, Stiers W, Zorowitz RD; American Heart Association Stroke Council, Council on Cardiovascular and Stroke Nursing, Council on Clinical Cardiology, and Council on Quality of Care and Outcomes Research. Guidelines for Adult Stroke Rehabilitation and Recovery: A Guideline for Healthcare Professionals From the American Heart Association/American Stroke Association. Stroke. 2016; 47 (6): e98-e169. doi: 10.1161/STR.0000000000000098. Erratum in: Stroke. 2017 Feb; 48 (2): e78. Erratum in: Stroke. 2017; 48 (12 ): e369.
129.Wissel J, Bensmail D, Ferreira JJ, Molteni F, Satkunam L, Moraleda S, Rekand T, McGuire J, Scheschonka A, Flatau-Baqué B, Simon O, Rochford ET, Dressler D, Simpson DM; TOWER study investigators. Safety and efficacy of incobotulinumtoxinA doses up to 800 U in limb spasticity: The TOWER study. Neurology. 2017; 88 (14): 1321-1328. doi: 10.1212/WNL.0000000000003789.
130.Wissel J, Fheodoroff K, Hoonhorst M, Müngersdorf M, Gallien P, Meier N, Hamacher J, Hefter H, Maisonobe P, Koch M. Effectiveness of AbobotulinumtoxinA in Post-stroke Upper Limb Spasticity in Relation to Timing of Treatment. Front Neurol. 2020; 11: 104. doi: 10.3389/fneur.2020.00104.
131.Wissel J, Manack A, Brainin M. Toward an epidemiology of post-stroke spasticity. Neurology. 2013; 80 (3 Suppl 2): S13-9. doi: 10.1212/WNL.0b013e3182762448.
132.Wissel J, Schelosky LD, Scott J, Christe W, Faiss JH, Mueller J. Early development of spasticity following stroke: a prospective, observational trial. J Neurol. 2010; 257 (7): 1067-72. doi: 10.1007/ s00415-010-5463-1.
133.Wissel J, Verrier M, Simpson DM, Charles D, Guinto P, Papapetropoulos S, Sunnerhagen KS. Post-stroke spasticity: predic-tors of early development and considerations for therapeutic inter-vention. PM R. 2015; 7 (1): 60-7. doi: 10.1016/j.pmrj.2014.08.946.
134.Wissel J, Ward AB, Erztgaard P, Bensmail D, Hecht MJ, Lejeune TM, Schnider P, Altavista MC, Cavazza S, Deltombe T, Duarte E, Geurts AC, Gracies JM, Haboubi NH, Juan FJ, Kasch H, Kätterer C, Kirazli Y, Manganotti P, Parman Y, Paternostro-Sluga T, Petropoulou K, Prempeh R, Rousseaux M, Slawek J, Tieranta N. European consensus table on the use of botulinum toxin type A in adult spasticity. J Rehabil Med. 2009; 41 (1): 13-25. doi: 10.2340/ 16501977-0303.
135.Yang EJ, Rha DW, Yoo JK, Park ES. Accuracy of manual needle placement for gastrocnemius muscle in children with cerebral palsy checked against ultrasonography. Arch Phys Med Rehabil. 2009; 90 (5): 741-4. doi: 10.1016/j.apmr.2008.10.025. PMID: 19406292.
136.Zeng H, Chen J, Guo Y, Tan S. Prevalence and Risk Factors for Spasticity After Stroke: A Systematic Review and Meta-Analysis. Front Neurol. 2021; 11: 616097. doi: 10.3389/fneur.2020.616097.